
题目列表(包括答案和解析)
4.(07年广东理基·19)下述做法能改善空气质量的是
A.以煤等燃料作为主要生活燃料
B.利用太阳能、风能和氢能等能源替代化石能源
C.鼓励私人购买和使用汽车代替公交车
D.限制使用电动车
3.(07年广东文基·62)下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
2.(09年广东理基·26)下列措施不符合节能减排的是
A.大力发展火力发电,解决广东电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
1.(09年广东文基·68)下列说法正确的是
A.废旧电池应集中回收,并填埋处理
B.充电电池放电时,电能转变为化学能
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
22.(09年山东理综·32)(8分)(化学-物质物质性质)
G和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO:中Si与O原子间不形成上述π健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健 。
21.(09年宁夏理综·38)[化学-选修物质结构与性质](15分)
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 ;
(2)Y元素原子的价层电子的轨道表示式为 ,该元素的名称是 ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 ;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是 ;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由 。
20.有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大. 已知B元素是地壳中含量最多的元素; A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的二分之一;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;六种元素的基态原子中,F原子的电子层数最多且和A处在同一主族.回答下列问题:
(1)用电子式表示C和E形成化合物的过程 。
(2)写出基态F原子的核外电子排布式 。
(3)用电子式表示A原子与D原子形成A2D分子的过程 。
(4)A、B、C共同形成的化合物中化学键的类型____________。
18.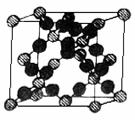 我们可以将SiO2的晶体结构想象为:在晶体硅的Si-Si键之间插入O原子.结构如右图所示.
我们可以将SiO2的晶体结构想象为:在晶体硅的Si-Si键之间插入O原子.结构如右图所示.
⑴根据SiO2晶体结构图,下列说法正确的是_________.
A.石英晶体中每个Si原子通过Si-O极性键与4个O原子作用
B.每个O原子也通过Si-O极性键与2个Si原子作用
C.石英晶体中Si原子与O原子的原子个数比为1∶2,可用“SiO2” 来表示石英的组成
D.在晶体中存在石英分子,故能叫分子式
(2)SiO44-离子结构可用 图表示,在聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是_____________ .
图表示,在聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是_____________ .
17.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断BeCl2中的化学键类型是______.
(2)根据上表给出的数据,简述主族元素X的数值大小与元素的金属性或非金属性强弱之间的关系____________________ ____ __________.
(3)请你预测Br与I元素的X数值的大小关系________.
(4)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于________原子(填元素符号).
16.在短周期主族元素中:
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是________(填元素名称).
(2)铝是活泼的金属元素,单质铝由于 而具有良好的抗腐蚀能力.美国化学家发现铝的“原子群”(如Al13、Al14、Al37)各具有与某种元素相似的化学性质,并符合元素周期律中的某些规律.例如:Al13与卤素具有相似的化学性质, Al13-离子具有惰性气体元素的性质,可推测Al14的化学性质与 族元素相似.
(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p 亚层上有3个电子.
①写出甲元素的电子排布式____________,乙元素的原子结构示意图________________.
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于____________晶体,其化学式为_______________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com