
题目列表(包括答案和解析)
3、现有化合物A:HC≡C-C≡C-C≡C-C≡C-C≡N。以下对该物质可以发生的有机化学反应所属类型的判断中,不正确的是( )。
A. 化合物A既可以与HCl发生加成反应,又可以与HCN发生加成反应
B. 化合物A能与酸性KMnO4溶液发生氧化反应
C. 化合物A可以发生消去反应
D. 化合物A能与溴的四氯化碳溶液发生加成反应
2、下列各组物质在一定条件下反应,可以制得较纯净的1,2-二氯乙烷的是( )
A.乙烷与氯气混合 B.乙烯与氯化氢混合
C.将乙炔通入氯的四氯化碳溶液中 D. 将乙烯通入氯的四氯化碳溶液中
1、下列烷烃的系统名称中,不正确的是( )
A.2,3-二甲基丁烷 B.3,3-二甲基丁烷
C.2-甲基-3-乙基戊烷 D.2,2,3-三甲基丁烷
30.(10分)有A、B、C、D、E、F六种元素,A是宇宙中最丰富的元素,B是周期表中电负性数值最大的元素,C的基态原子中2p轨道有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两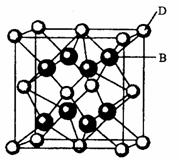 种氧化物,D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
种氧化物,D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
(1)E元素原子基态时的外围电子排布式为 。
(2)A2F分子中F原子的杂化类型是 ,F的气态氧化物FO3分子的键角为 。
(3)CA3极易溶于水,其原因主要是 ,试判断CA3溶于水后,形成CA3·H2O的最合理结构为 (填字母)。
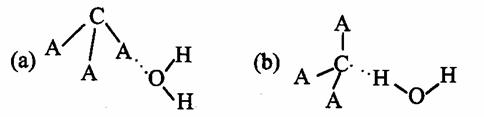
(4)从图中可以看出,D跟B形成的离子化合物的电子式为 ;该离
子化合物晶体的密度为ag· cm-3。,则晶胞的体积是 (只要求列出算式)。
长春市十一高中2009-2010学年度高二下学期阶段性考试
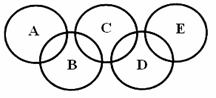
29.(16分)夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
⑴火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
⑵下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为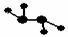 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为______________ _________,D的化学式是_____ ____。
②A、B、E中均含有的一种元素为____________ (填元素名称) 。
③E电子式为____________________。
④液态B与液态E反应可生成一种气态单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为________________________________________________________。
⑤NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸时,发生反应的化学方程式 。
⑶在实验室我国科研人员应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似。已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60分子的结构中含有_________个N-N。
28.(16分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
A |
|
R |
|||||||||||||||
|
B |
|
|
|
C |
D |
E |
F |
T |
|||||||||
|
G |
H |
I |
J |
|
K |
L |
|
||||||||||
|
|
|
|
|
|
M |
|
N |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为__ _ _ _ _ _ _ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
(5)要证明太阳上是否含有R 元素,可采用的方法是 。
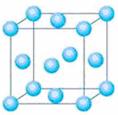 (6)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
(6)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有_______________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为 。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___________________________(填分子式)。
27.(10分)氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为____ _______。
(2)根据等电子原理,CO与N2互为等电子体,请写出CO分子结构式 。
(3)在极性分子NCl3中,N元素的化合价为-3,Cl元素的化合价为+1,请推测NCl3水解的主要产物是 (填化学式)。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
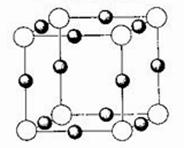 (5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如下图所示。X的元素符号是_____________,与同一个N3-相连的X+有__________个。
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如下图所示。X的元素符号是_____________,与同一个N3-相连的X+有__________个。
26.(8分)有A、B、C、D、E 五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)以上这五种元素中,属于S区的是________________________________(填元素符号)。
(2)由这五种元素组成的一种化合物是_______________________________(写化学式)。
(3)写出D元素基态原子的最外层电子排布图__________________________________。
(4)元素电负性为B_______D,元素第一电离能为C______E。(填“﹥”、“﹤”或“﹦”)
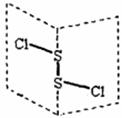
25. 氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。
氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。
 下列说法错误的是(
)
下列说法错误的是(
)
A.S2Cl2的结构式为Cl-S-S-Cl
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
第Ⅱ卷
24.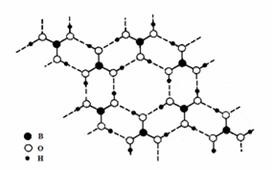 正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e--稳定结构
D.含1molH3BO3的晶体中有3mol氢键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com