
题目列表(包括答案和解析)
6.以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极上析出铜的质量是 ( )
A.8g B.16g C.32g D.64g
5.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
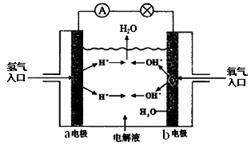 A.a电极是负极
A.a电极是负极
B.b电极的电极反应为:4OH--4e- =2H2O+O2
C.氢氧燃料电池是一种具有应用前景的绿 色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
4.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
3.由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH值 ( )
A.不变 B.先变小后变大 C.逐渐变大 D.逐渐变小
2.已知:CH3CH2CH2CH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);DH =-2878 kJ/mol
4CO2(g)+5H2O(l);DH =-2878 kJ/mol
(CH3)2CHCH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);DH =-2869 kJ/mol
4CO2(g)+5H2O(l);DH =-2869 kJ/mol
下列说法正确的是( )
A.正丁烷分子储存的能量大于异丁烷分子 B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程 D.异丁烷分子中的碳氢键比正丁烷的多
1.为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是( )
A.采用电解水法制取氢气作为新能源 B.完善煤液化制取汽油的技术
C.研制推广以甲醇为燃料的汽车 D.进一步提高石油加工工艺
29.(14分)常温下,将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如下:
(1)A 点pH 7(填“<”、“>”或“=”),原因是 (用相应的文字或者方程式说明,下同)
(2)AB段pH升高的原因是
(3)写出BC段电解过程中反应的离子方程式
(4)CD段pH降低的原因是
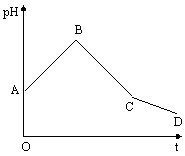 (5)已知C点的pH等于2,试求电解前混合溶液中CuSO4物质的量浓度(不考虑电解过程中溶液的体积变化)
(5)已知C点的pH等于2,试求电解前混合溶液中CuSO4物质的量浓度(不考虑电解过程中溶液的体积变化)
 瑞安中学2009学年第二学期高二期中考试
瑞安中学2009学年第二学期高二期中考试
28.(14分) 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l);ΔH=-44.0KJ·moL-1
(1)氢气的燃烧热△H= kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式

(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为
;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动
(4)为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
27. (10分) 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+
(10分) 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,记录初始读数和终点读数。④重复上述操作2次,记录数据如下表。
|
草酸晶体质量/g |
KMnO4标准溶液初读数/ml |
KMnO4标准溶液末读数/ml |
|
1.260 |
0.00 |
9.98 |
|
1.260 |
0.02 |
10.02 |
|
1.260 |
0.20 |
10.22 |
请回答:
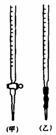
⑴ 滴定时,将KMnO4标准液装在上图中的 (填“甲”或“乙”)滴定管中。
⑵ 本实验滴定达到终点的标志可以是 。
⑶ 通过上述数据,计算出x= 。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
26. (12分)(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
(12分)(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
 Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
 ①该反应的平衡常数表达式为:K=
。
①该反应的平衡常数表达式为:K=
。
 ②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单
 质铁11.2g。则10min内CO的平均反应速率为
。
质铁11.2g。则10min内CO的平均反应速率为
。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ;(用化学式表示,下同)
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
(4)在25℃下,将一定物质的量浓度的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);溶液中各离子浓度的大小关系为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com