
题目列表(包括答案和解析)
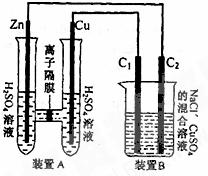
27.有右下图装置:回答下列问题:
(1)装置A是_______池,B是_______池。
(2)装置A中的Zn极是_______极,Cu极上的电极反应方程式 为:__________________。
(3)锌与铁组成的合金在潮湿的空气中,发生腐蚀,其正极反应 式为__________________ 。
(4)装置B中两极为石墨棒C1,C2。池中是浓度均为0.2mol/L的NaCl、CuSO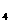 混合溶液,溶液体积为500mL。当装置A中Zn棒质量减少32.5g时,C
混合溶液,溶液体积为500mL。当装置A中Zn棒质量减少32.5g时,C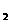 上质量增加____________g;
上质量增加____________g;
26.(1)碳酸的水溶液呈酸性,原因是(用离子方程式表示): 。
(2)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
(3)氯化铝溶液具有净水的作用,原因是(用离子方程式表示):_______ _____
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
 (4)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,常温下1g甲硅自燃放出的热量为44.6KJ,其热化学方程式为
。
(4)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,常温下1g甲硅自燃放出的热量为44.6KJ,其热化学方程式为
。
25.在恒温恒压的密闭容器中,充入 4L
X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)  2Q(g)+ nR(g)达到平衡时测得 X的转化率为 25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是: ( )
2Q(g)+ nR(g)达到平衡时测得 X的转化率为 25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是: ( )
A.3 B.5 C.6 D.8
卷Ⅱ(非选择题 共50分)
24.将铂电极放置在盐酸溶液中,然后分别向两极通入CH4和O2即可产生电流,称为燃料电池。下列叙述正确的是:( )
A 通甲烷的电极为正极
B通甲烷的电极反应式是:CH4+2O2+4e-=CO2+2H2O
C正极的电极反应式为: O2+4H++4e-=2H2O
D 正极的电极反应式是:CH4+10OH--8e-=CO32-+7H2O
23. 根据化学平衡知识,判断下列说法正确的是:( )
A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:
c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.在小苏打溶液中存在下列关系: c(HCO3-)=c(Na+)-c
(CO32-)-c(H2CO3)
c(HCO3-)=c(Na+)-c
(CO32-)-c(H2CO3)
C.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大
D.常 温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
22.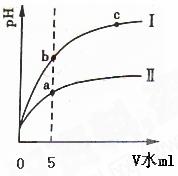
 某温度下,分别稀释等pH值的盐酸和醋酸,溶液pH随加入水的体积变化的曲线如右图所示。据图判断下列说法正确的是
某温度下,分别稀释等pH值的盐酸和醋酸,溶液pH随加入水的体积变化的曲线如右图所示。据图判断下列说法正确的是 : ( )
: ( )
A.Ⅰ为醋酸稀释时pH变化曲线
B.溶液的导电性:b>a>c
C.取 “0”处等体积两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸
D.取5mL处等体积两者溶液分别与相同的Zn粒反应,刚开始时的反应速率:Ⅰ>Ⅱ
21、在一体积固定的密闭容器中进行下列反应:2SO2+O2 2SO3(g),当反应达到平衡时SO2、O2、SO3的浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.2
mol·L-1,则反应起始时的部分物质的数据不可能是:( )
2SO3(g),当反应达到平衡时SO2、O2、SO3的浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.2
mol·L-1,则反应起始时的部分物质的数据不可能是:( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1 B.SO2为0.25 mol·L-1
C.SO2,SO3均为0.15 mol·L-1 D.SO3为0.4 mol·L-1
20.反应2X(g)+Y(g) 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
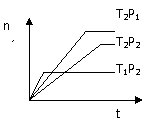 A.T1<T2,P1<P2
A.T1<T2,P1<P2
B.T1 <T2,P1>P2
<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
19.不能用勒沙特列原理解释的是:( )
A.鼓入空气有利于SO3的生成
B.棕红色的NO2加 压后颜色先变深后变浅
压后颜色先变深后变浅
C.加大压强更有利于合成氨
D.由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
18.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的( )
A. 滴加酚酞试液显红色的溶液 Fe3+、NH4+、Cl-、SCN-
B. 水电离出来的c(H+) =10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+
C. 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+
D. pH=1的溶液 Cu2+、Na+、Mg2+、NO3-
=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+
C. 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+
D. pH=1的溶液 Cu2+、Na+、Mg2+、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com