
题目列表(包括答案和解析)
6.某有机物在空气中完全燃烧时,生成二氧化碳和水的分子个数比为1: 2,则该有机物可能是 ( )
① CH4 ② C2H4 ③ C2H5OH ④ CH3OH
A.①或③ B.②或③ C.①或④ D.②或④
5.下列电子式正确的是
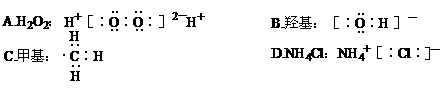
4.下列有机物分子中的各原子不可能在同一平面上的是
A.苯 B.四氯化碳 C.乙烯 D.乙炔
3.下列有机物的命名中,正确的是:( )
A.1-甲基丙烷 B.2-乙基丁烷
C.3,3-二甲基丁烷 D.2-甲基丁烷
2.为减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是
A.碳水化合物 B.碳氢化合物 C.氢气 D.醇类
1.不粘锅 是在普通锅的内侧涂覆上一层树脂而成,这层树脂的主要成分是聚四氟乙烯。洗衣店干洗西装是用有机溶剂来洗衣服的,目前使用的标准干洗剂的主要成分是四氯乙烯。关于聚四氟乙烯和四氯乙烯,下面的说法正确的是
是在普通锅的内侧涂覆上一层树脂而成,这层树脂的主要成分是聚四氟乙烯。洗衣店干洗西装是用有机溶剂来洗衣服的,目前使用的标准干洗剂的主要成分是四氯乙烯。关于聚四氟乙烯和四氯乙烯,下面的说法正确的是
 A.它们都是乙烯的同系物
B.它们都属于混合物
A.它们都是乙烯的同系物
B.它们都属于混合物
 C.它们的分子中都含有C=C双键 D.它们分子中都不含氢原子
C.它们的分子中都含有C=C双键 D.它们分子中都不含氢原子
22.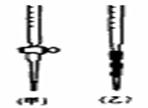 (10分)现用物质的量浓度为amol·L-1的标准NaOH溶液去滴定VmL盐酸的物质的量浓度,请填写下列空白:
(10分)现用物质的量浓度为amol·L-1的标准NaOH溶液去滴定VmL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________________________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (选填“甲”或“乙”)中。
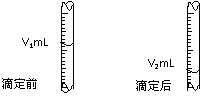 (3)右图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______________mol·L-1。
(3)右图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______________mol·L-1。
(4)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定 管尖嘴部分气泡消失,则滴定的HCl物质的量浓度会偏____________(填“大”或“小”)。
(5)取20.00 mL待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
|
实验编号 |
NaOH溶液的浓度(mol·L-1) |
滴定完成时, NaOH溶液滴入的体积(mL) |
待测盐酸的体积(mL) |
|
1 |
0.10 |
22.62 |
20.00 |
|
2 |
0.10 |
22.72 |
20.00 |
|
3 |
0.10 |
22.80 |
20.00 |
①滴定达到终点的标志是______________________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
21.(13分)已知NaHSO3溶液显酸性,而Na2SO3溶液显碱性。
(1)25℃时,在20.0mL0.5mol·L-1的NaOH溶液中,通入标准状态下的224mLSO2,所得溶液显______(填“酸”或“碱”)性,原因是_______________________________(用 化学用语表达),溶液中所含有的离子浓度由大到小的顺序为_______________________________。
(2)在上述溶液中逐滴加入1mol·L-1NaClO溶液至20mL,反应的离子方程式为____________________。当滴加NaClO至10mL时,溶液中由水电离的H+离子浓度为______________mol·L-1。滴加至20mL时溶液中离子浓度由大到小的顺序为_____________________________________________。
(3)若在(2)反应后的溶液中滴加少量甲基橙,溶液显_________色。
20.(13分)某校化学小组学生利用下图装置进行“氨的催化氧化及其产物验证”实验。
(图中夹持装置已略去)
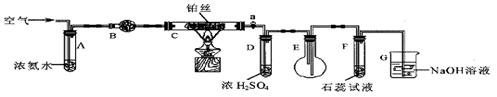
(1)装置B中盛放的试剂是__________(填名称),用来吸收混合气体中的水汽。
(2)反应开始时,将装置C中铂丝加热到红热,撤去酒精灯,铂丝变暗。此时鼓入空气,铂丝又变红热。写出C中反应的化学方程式_______________________________________。
(3)实验过程中,装置D中的导管容易生成无色晶体而堵塞。为了解决该问题,可以在活塞a后增加______(选填序号)。
①盛有蒸馏水的洗气瓶 ②盛有浓盐酸的洗气瓶 ③盛有碱石灰的U形管
(4)装置E中的含氮化合物有NH3、NO、NO2、________________(填化学式)。
(5)F中紫色石蕊试液变红,G装置的作用 ___________________________。
 (6)工业上合成氨的反应是:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ·mol-1。
(6)工业上合成氨的反应是:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ·mol-1。
①下列做法能够提高工业合成氨转化率的是_________(选填字母)
a.增大压强 b.升高温度 c.使用铁触媒 d.将生成的NH3及时从混合气体中分离出去
②工业合成氨时采用500℃左右的温度,主要是因为________________。
19.(10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。试回答下列问题:
(1)写出化学式:A___________________ D_________________________。
(2)写出A与E反应的离子方程式_____________________________________________。
(3)25℃时将40mL0.01mol·L-1B与20mL0.01mol·L-1C混合,最终溶液pH=____________。
(4)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com