
题目列表(包括答案和解析)
26.(13分)为测定碳酸钙样品(含杂质二氧化硅)的纯度,
某兴趣小组的同学设计了如下几个实验方案:
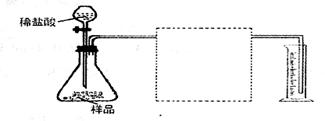
方案Ⅰ:①称取碳酸钙样品mg②用c1mol·L-1盐酸V1mL(过量)溶解样品③取溶解后的溶液体积的十分之一,用c2mol·L-1NaOH溶液滴定,恰好用去V2mL
方案Ⅱ:①称取碳酸钙样品mg ②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为m1g.
方案Ⅲ:①称取碳酸钙样品mg②加入c1mol·L-1盐酸V1mL(过量)溶解样品③过滤并取出滤液④在滤液中加入过量c3mol·L-1Na2CO3溶液V3mL⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为m2g。
根据以上实验方案,回答下列问题:
(1)方案I中碳酸钙纯度计算公式为 。
(2)方案Ⅱ中高温锻烧样品应在 (填写仪器名称)中进行;为保证实验的准确性,整个实验过程中至少要称量 次。
(3)方案Ⅲ中不需要的数据是 (填选填编号)。
A.c3、V3 B.c1、V1 C.m2 D.m
(4)方案Ⅲ中为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液中体积为V3mL
B.精确配制Na2CO3溶液浓度为c3mol·L-1
C.将步骤③所得沉淀洗涤,洗液并入④中
(5)方案IV:称取碳酸钙样品mg,按下图装置进行实验,根据实验原理,在图中方框内补充必要的仪器,并注明所用试剂名称。
 温州中学2009学年第二学期期末考试
温州中学2009学年第二学期期末考试
25.(14分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化氢的含量。请填写下列空白:
(1)移取10.00 mL密度为ρ g·mL-1的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。

(3)滴定时,将高锰酸钾标准溶液注入_________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是__________________________________________________________。
(4)重复滴定三次,平均耗用c mol·L-1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)请将他们的实验方法和实验现象填入下表:
|
实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证不稳定性 |
|
|
24、(4分)阿魏酸在食品、医药等方面有若广泛用途。一种合成阿魏酸的反应可表示为
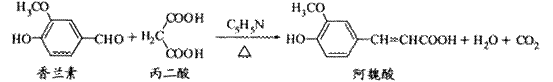
下列说法正确的是
A. 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
23.(12分)在25℃时,用石墨电极电解2.0 L0.5 mol·L-1CuSO4溶液。5 min后,在一个石墨电极上有6.4g Cu生成。试回答下列问题:
(1)发生氧化反应的是 极,电极反应式为________________________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为____________
(3)若将溶液恢复到与电解前一样,则需加入________mol的___________
(4)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差_______g ,电解液的pH _________。(填“变小”、“变大”或“不变”)
22.(6分)A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是__________。
(2)D与E反应的离子方程式是____________________________________________
(3)A与E反应的离子方程式是 。
21.(6分)海带中含有丰富的碘元素,某课外兴趣小组设计了下列从海带中提取碘的实验流程:
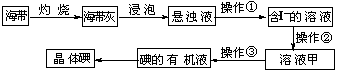
⑴海带灰浸泡过程中常用玻璃棒搅拌的目的是 。
⑵操作①的名称是____________,操作③使用的玻璃仪器有 、 。
⑶操作②是:向含I-的溶液中滴入几滴稀硫酸,再加入一定量质量分数为3%的H2O2。发生反应的离子方程式是______________________________。
20.下图表示4-溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是
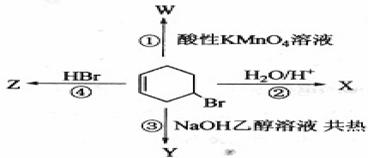
A. ③④ B.②③ C.①② D.①④
Ⅱ卷
19.下列叙述的实验能达到预期目的的是:
|
选项 |
实验内容 |
实验目的 |
|
A |
将含有HCl杂质的CO2通入饱和Na2CO3溶液中 |
除去CO2中的HCl |
|
B |
向少量火柴头的浸泡液中滴加AgNO3、稀HNO3和NaNO2 |
验证火柴头含有硫元素 |
|
C |
市售阿司匹林药品研碎后加蒸馏水溶解,滴加1-2滴1%的氯化铁溶液 |
水杨酸杂质的鉴别 |
|
D |
分别向2支试管中加入相同体积不同浓度的Na2S2O3溶液,再向其中分别加入不同浓度的H2SO4溶液 |
研究反应物浓度对化学反应速率的影响 |
18.已知H2(g)+I2(g) 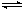 2HI(g) △H<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g) △H<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲降低温度,乙不变 B.甲中加入0.1mol He,乙不改变
C.甲、乙提高相同温度 D.甲增加0.1mol H2,乙增加0.1mol I2
17.下列各组离子,在指定条件下,一定能大量共存的是:
①某无色透明的酸性溶液中:Cl-、Na+、CrO42-、SO42-
②水电离产生的c(H+)=10-12mol·L-1的溶液中:K+、Ba2+、Cl-、NO3-
③使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl-
④加入过量NaOH溶液后可得到澄清溶液:K+、Ba2+、 HCO3-、C1-
⑤c(H+)<c(OH-)的溶液中:ClO-、Cl-、K+、Na+
⑥在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO-
⑦能使pH试纸变深蓝色的溶液中:Na+、AlO2-、K+、CO32-
A.①③④⑥⑦ B.②③⑤⑦ C.②⑤⑦ D.②④⑤⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com