
题目列表(包括答案和解析)
6.
 有一未完成的离子方程式:
+XO3-+6H+=3X2+3H2O,据此判断X元素的最高化合价为
有一未完成的离子方程式:
+XO3-+6H+=3X2+3H2O,据此判断X元素的最高化合价为
A.+7 B.+5 C.+4 D.-1
5.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是
A.Na+、K+、Cl-、OH- B.H+、Na+、SO42-、NO3-
C.K+、Ca2+、NO3-、SO32- D.Na+、Mg2+、S2-、MnO4-
4.氮化钠和氢化钠与水反应的化学方程式如下:Na3N + 3H2O =3NaOH + NH3,
NaH + H2O =NaOH + H2↑。有关Na3N和NaH的叙述正确的是
A.离子半径:Na+>N3->H+ B.与水反应都是氧化还原反应
C.加热熔化时,都只破坏离子键 D.与盐酸反应都只生成一种盐
3.下列物质的分类正确的是
|
|
混合物 |
非电解质 |
碱 |
酸式盐 |
|
A |
漂白粉 |
氯气 |
氨水 |
碳酸氢钠 |
|
B |
福尔马林 |
苯 |
碱式碳酸铜 |
明矾 |
|
C |
胆矾 |
二氧化硫 |
纯碱 |
氯化铵 |
|
D |
食醋 |
乙醇 |
苛性钾 |
硫酸氢钠 |
2. 下列有关化学用语或名称表达正确的是
下列有关化学用语或名称表达正确的是
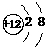 A.Mg的原子结构示意图:
B.乙炔的分子模型示意图:
A.Mg的原子结构示意图:
B.乙炔的分子模型示意图:

C.H2O2的电子式: D.乙烯的结构简式:CH2=CH2
1.由解放军总装备部军事医学研究所研制的小分子团水,具有高渗透力、高扩散力、高溶解力等特点。一次饮用125 mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是
A.水分子的化学性质发生改变 B.水的物理性质改变
C.水分子间以共价键缔合 D.水分子中氢氧键长缩短
31.(14分)在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
  |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)求b、e的值:b= ,e=
(2)计算20s-40s内用N2O4表示的平均反应速率为 ;80℃该反应的化学平衡常数K为 。^S*5U.C#O%下
(3)改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号) 。
A.向混合气体中再通入N2O4 B.保持容积不变,通入He
C.使用高效催化剂 D.降低温度
 (4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”) ^S*5U.C#O%下
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”) ^S*5U.C#O%下
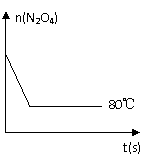
(5)如图是80℃时容器中N2O4物质的量的
变化曲线,请在该图中补画出该反应在60℃时
N2O4物质的量的变化曲线
29.(9分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
(1)该实验应选用 作指示剂。^S*5U.C#O%下
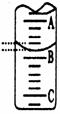 (2)右图表示50mL滴定管中液面的位置,若A与C刻度间
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间
相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;
反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每
次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次
实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
 从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过^S*5U.C#O%下
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L。
|
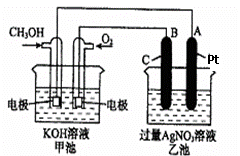 2CH3OH+3O2+4KOH
2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的有关问题:
甲池是 装置,
B(石墨)电极的名称是 。
(2)写出电极反应式:^S*5U.C#O%下
通入O2的电极的反应式 。
A(Pt)电极的反应式为 ,
(3)乙池中反应的化学方程式为 。
(4)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为 (标准状况下);
②乙池中所得溶液的pH= 。
28.下列有关判断正确的是
A.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:^S*5U.C#O%下
Al-3e-+3OH-=Al(OH)3
C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ D.用原电池和电解池装置都能实现2HCl + Cu CuCl2
+ H2↑ 反应
CuCl2
+ H2↑ 反应
27.已知:在100℃时,纯水的c(H+)为1×10-6,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为
A.1∶9 B.10∶1 C.9∶1 D.1∶10
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com