
题目列表(包括答案和解析)
3、下列离子方程式中,书写正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3+
+ 3H2O Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B.用小苏打治疗胃酸过多:HCO3- + H+ = CO2↑+ H2O
C.向Na2CO3溶液中加入过量CH3COOH溶液: CO32-+2H+ = CO2↑+H2O
D.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+
2.下列有关海水综合利用的说法正确的是
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.从海带中提取碘单质的过程不涉及氧化还原反应
1.2010年上海世博会的主题是“城市,让生活更美好”。下列叙述中不正确的是
A.世博会前期,处理废水时加入明矾可作为混凝剂以吸附水中的杂质
B.世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染
C.世博会中国馆--“东方之冠”使用的钢筋混凝土属于高分子化合物
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
21.400 mL NaNO3和AgNO3的混合溶液中c(NO3-)=4 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),假设电解后溶液体积仍为400 mL。试计算
(1)上述电解过程中转移电子的物质的量
(2)电解后溶液中的c(H+)
20.(10分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀 H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol·L-1NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点?
。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol·L-1 (计算出结果到小数点后二位)
19.(6分)下列有关实验操作或结果的说法中正确的是 (在给出的选项中,至少有两项是符合题目要求的)
A.将pH试纸用蒸馏水湿润后,测量某溶液的pH
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
F.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
18.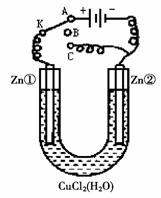 (13分)在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如右图:
(13分)在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如右图:
(1)如果把电键K接A,这一装置形成_________装置,Zn①极
是________极,其电极反应式是_____ _ ______;
Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成
____________装置,Zn①极是__________极,该装置发生
反应的总化学方程式是___________________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐
蚀属于_________,被腐蚀的金属是_____,Zn①极发生的腐蚀主要
属于____________。
17.(8分)(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__ (填序号)。
A.9 B.13 C.11-13之间 D.9-11之间
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)_______c(CH3COO-) ( “>”、“=”或“<”)。
(3)常温下,0.10mol/LNH4Cl溶液中各离子浓度由大到小的顺序是_____________ _。
(4)将NaHCO3溶液跟Al2(SO4)3溶液混合,现象是 ,相关反应的离子方程式是 。
16.(10分).在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
 已知:K300℃>K350℃,则该反应是 热反应。
已知:K300℃>K350℃,则该反应是 热反应。
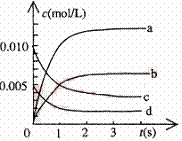
(2)右图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
15.(5分)已知下列两个热化学方程式:
H2(g)+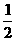 O2(g)====H2O(l)△H=-128.5kJ·mol-1
O2(g)====H2O(l)△H=-128.5kJ·mol-1
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
(1)实验测得H2和C3 H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3 H8的体积比是 ;
(2)已知:H2O(l) H2O(g) △H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式
。
H2O(g) △H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com