
题目列表(包括答案和解析)
2.下列说法中不正确的是( )
A. 有单质参加或有单质生成的反应不一定是氧化还原反应
B. 金属单质在化学反应中一定作为还原剂
C. 化合反应一定是氧化还原反应
D. 复分解反应一定不是氧化还原反应
1.下列变化中属于化学变化的是( )
A.碘的升华 B.一束强光照射淀粉胶体出现光亮的通路
C.NaCl在水中电离 D.蓝色的胆矾常温下变白
29.将14.7克镁、铝合金全部溶于500毫升 6摩/升的盐酸中,充分反应后,再加入400毫升 8摩/升的NaOH溶液,结果得到26.3克沉淀,求合金中各组分的质量。
 河大附中2009--2010学年理科竞赛
河大附中2009--2010学年理科竞赛
28.在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如下框图所示),已知气体G与空气之密度比约为1.17
请填空:⑴ 组成单质X和Y的元素分别属第 族和第 族。
⑵ 化合物Z的化学式为 。
⑶ 每生成1mol的气体G,同时应得到 mol的沉淀P。

27.已知pH = 2的高碘酸(H5IO6)溶液与pH = 12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH = 12的NaOH溶液等体积混合,所得混合液显中性。请回答下列问题:
(1)高碘酸是 (填写“强酸”或“弱酸”),理由是___________________
。
(2)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸,碘酸和硫酸,此反应的氧化剂是_________,高锰酸是 产物(填“氧化”或者“还原”), 高碘酸的氧化性比高锰酸要 (填“强”或者“弱”)
(3)在定量分析化学反应中各物质的计量关系时,往往可利用质量守恒、离子电荷守恒和得失电子守恒等规律将问题简单化。现有单质铁溶于稀硝酸反应的化学方程式可表示为:a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO↑+ h N2O↑+ k H2O
下列各种情况下的数学等量关系式为:
①b、c、d、f的数学关系式为_____________。
②d、f、g、h的数学关系式为_____________。
③c、g、h的数学关系式为_______________。
26.通常,烷烃可以由相应的烯烃经催化加氢得到。但是,有一种烷烃A,分子式C9H20 ,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,却分别可由而且只能由1种自己相应的烯烃催化加氢得到。A 、B1、B2、B3的结构简式如下(请填空)
 A:
B1-B3:
A:
B1-B3:


25.某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol·L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液。发生的反应为:
5H2C2O4+2KMnO4+3H2SO4 = 5CO2↑+2MnSO4+K2SO4+8H2O
(1)KMnO4溶液应盛在_________(填“酸式”或“碱式”)滴定管中。
(2)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20 mL,则滴定管中液体的体积为______(填代号)。
A.5.20 mL B.19.80 mL C.大于19.80 mL D.小于19.80 mL
(3)本实验是否需要外加指示剂? (填“是”或者“否”)。到达滴定终点时,溶液的颜色由 色变为 色。
(4)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(5)该牛奶中钙的含量为_________mg/100mL。
(6)下列操作会使实验结果偏低的是____________(填代号)。
A.滴定管未用KMnO4溶液润洗就直接盛装KMnO4溶液
B.向锥形瓶转移沉淀时,损失部分沉淀
C.开始时平视读数,滴定完成时俯视读数
D.CaC2O4的表面没有洗涤干净,吸附少量C2O42-等杂质
24.工业制硝酸的主要反应是:
4NH3(g)+5O2(g)  4NO(g)+6H2O (g);△H = -1025 kJ·mol-1
4NO(g)+6H2O (g);△H = -1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。

(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
|
起始 |
0.8 |
1.6 |
0 |
|
第2min |
0.6 |
a |
0.2 |
|
第4min |
0.3 |
0.975 |
0.5 |
|
第6min |
0.3 |
0.975 |
] |
|
第8min |
0.8 |
1. 6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是______________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/(L·min);
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是___________________________________。
23.设X、Y、Z代表3种元素。已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9个;③Y和Z两元素可以形成四核42个电子的负一价阴离子。据此,请填空:
⑴Y元素是 ,Z元素是 。
⑵由X、Y、Z三元素所形成的含68个电子的盐类化合物之分子式(即化学式)是
22.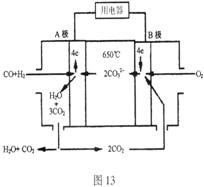 熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为
熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为
650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
请回答下列问题:
(1)B极为_________极,发生_________(填“氧化”或“还原”)反应
(2)电池总反应为_______________________________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。电解后溶液体积为1 L,溶液的PH约为 。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是
(用化学方程式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com