
题目列表(包括答案和解析)
4、某化学反应其ΔH = 122 kJ/mol,∆S = 231 J/(mol·K),则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
3、下列说法不正确的是
A、焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行
B、自发进行的反应一定能迅速进行
C、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
D、一个反应能否自发进行,与焓变和熵变的共同影响有关
2、把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
A.盐酸的浓度 B.铝条的表面积 C.溶液的温度 D.加少量Na2SO4固体
1、下列对化学反应的认识错误的是
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
25.(8分)将一块金属钠投入到100 mL MgCl2和AlCl3的混合溶液中,发现沉淀先多后少。反应完毕后收集到13.44 L气体(标准状况下),同时得到21.4 g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6 g。求原溶液中Mg2+、Al3+的物质的量浓度。
2009-2010学年度下学期开原高中高二第三次月考考试
24.(13分) 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
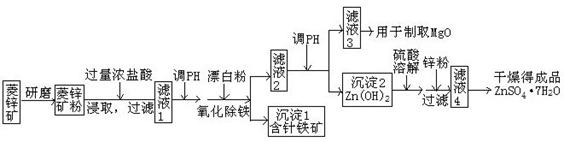
(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____=□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为_____ _。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀的pH |
10.4 |
6.4 |
- |
- |
|
沉淀完全的pH |
12.4 |
8.0 |
- |
- |
|
开始溶解的pH |
- |
10.5 |
- |
- |
|
Ksp |
5.6×10-12 |
- |
6.8×10-6 |
2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
23、(10分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
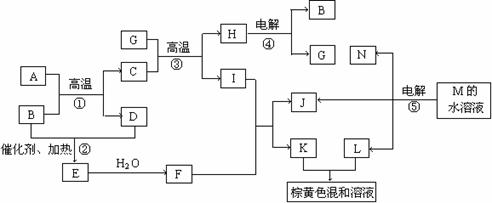
(1)写出A、B的化学式A B
(2)写出下列化学反应方程式:
反应②的化学方程式 ;
反应③的化学方程式 ;
反应⑤的离子方程式 。
22.(6分)已知下列变化过程中,0.2
mol 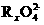 参加反应时共转移 0.4 mol 电子。
参加反应时共转移 0.4 mol 电子。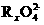 +
+ +H+
+H+ RO2+Mn2++H2O
RO2+Mn2++H2O
(1)x的值为 。
(2)配平上述氧化还原反应(用具体数字)。
⑶用单线桥标出电子转移方向和数目。
21.(13分)Ⅰ.把氯化亚铁水溶液中的Fe2+氧化为Fe3+,而不引进金属离子或其它原溶液中
不含有的阴离子,所用的三种方法的离子方程式分别为:
① ___________________ ______________________
② __________________ _______________________
③ ______________________ ___________________
Ⅱ.在装有固体A的试管中加入无色溶液B(足量),此时A未溶解.但加入一定量的水,
A即逐渐溶解.并有气体生成,溶液变为浅绿色.将空气通入该试管的溶液中,溶液颜色
很快加深.请填写下列空白:
(1)B的化学式是
(2)A加水后才溶解,其理由是
20.在一定温度下,向某饱和硫酸钠溶液中加入a g无水Na2SO4粉末,搅拌、静置后,析出bg Na2SO4·10H2O晶体。下列量中,可以根据已知条件计算的
①该温度下硫酸钠的溶解度 ②原饱和溶液减少的水的质量
③原饱和溶液减少的溶质的质量 ④析出晶体中含Na2SO4的质量
A.②④ B.②③④ C.①②④ D.①②③④
第Ⅱ卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com