
题目列表(包括答案和解析)
6.某物质熔融状态可导电,固态可导电,将其投入水中水溶液也可导电,则可推测该物质可能是 ( )
A.金属 B.非金属 C.可溶性碱 D.可溶性盐
5.萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为 ( )
A.2 B.4 C.6 D.8
4.下列化合物中含有手性碳原子的是 ( )
A.CF2 B. C.CH3CH2OH D.--COOH
3.下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是 ( )
A.碘和氯化钾 B.金刚石和重晶石
C.二氧化硅和干冰 D.软脂酸甘油酯和冰醋酸
2.下面的排序不正确的是 ( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小: NaF> NaCl> NaBr>NaI
1.科学家对原子结构的认识顺序正确的是 ( )
①道尔顿原子模型 ②汤姆生原子模型 ③卢瑟福原子模型 ④电子云模型
A.①③②④ B.④①②③ C.④②③① D.①②③④
19.(12分)
(1)在250C、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:ks*5u
________________________________________________________________________。
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=== CO2(g); △H=-394kJ·mol-1;
2CO(g)+O2(g)=== 2CO2(g); △H=-566kJ·mol-1;
2H2(g)+O2(g)=== 2H2O(g); △H=-484 kJ·mol-1;
①在25℃、101KPa时,1 g 甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:
_____________________________________________________________________。
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气
和一氧化碳的热化学方程式 。
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧
气。写出负极的电极反应式 。
②下列有关甲醇燃料电池的说法中,错误的是_________
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO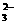
D.甲醇燃料电池中使用的氢氧化钾浓度保持不变
18.(10分)W、X、Y、Z是短周期主族元素,它们的核电荷数依次增大。下表列出它们的性质和原子结构:
|
元素编号 |
元素性质或原子结构 |
|
W |
原子电子层数与核外电子数相等 |
|
X |
核外s能级上的电子总数与p能级上的电子总数相等 |
|
Y |
元素的原子半径在该周期中最大(除稀有气体外) |
|
Z |
原子核外p能级上的电子总数比s能级上的电子总数多2 |
(1)元素符号:X_______________,Z________________。
(2)Y元素原子的核外电子排布式为__________________。
(3)X元素原子的核外有 种不同形状的电子云。
(4)Y元素的单质在W和X形成的化合物中反应的离子方程式为
___________________________________________________________________ 。
17.(12分)在2L密闭容器中,800℃时反应2NO(g)+O2(g)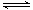 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=__________________________。
已知:K(300℃)>K(350℃),该反应是__________热反应(填“放”或“吸”)。
(2)上述反应达平衡时,NO的转化率=__________________。
(3)下图中表示NO2的变化的曲线是____________(选填字母,下同)。
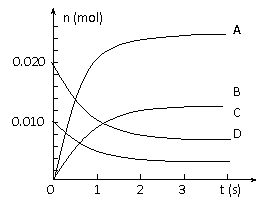
(4)能说明该反应已经达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.NO和NO2两物质的浓度相等
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂
16.(12分)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.CO2与化合物A反应生成化合物B,如下反应式(其它试剂、产物及反应条件均省略)。ks*5u
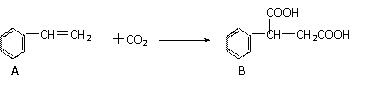
(1)化合物B的分子式为__________,1 mol该物质完全燃烧需消耗_________mol O2 。
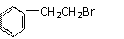
(2)由 通过消去反应制备A的化学方程式为(注明反应条件):
_______________________________________________________________________。
(3)B与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为:
__________________________________________。
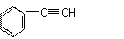 (4)与CO2类似,CO也能被固定和利用。在一定条件下,CO、
和
(4)与CO2类似,CO也能被固定和利用。在一定条件下,CO、
和
H2三者发生反应(苯环不参与反应),生成化合物C的分子式为C9H8O,且物质C能发生银镜反应。写出生成物C可能的结构简式:
___________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com