
题目列表(包括答案和解析)
7、下列说法正确的是
A.同温同压下甲烷和氧气的密度之比为2:1
B.1g甲烷和1g 氧气 的原子数之比为 5:1
C.等物质的量的甲烷和氧气的质量之比为2:1
D.在标准状况下等质量的甲烷和氧气的体积之比为1:2
6、据报道,某星球大气中含有一种称为硫化羰(COS)的化合物,其分子结构与二氧化碳类似,能在氧气里燃烧。下列关于硫化羰的说法正确的是
A.二氧化碳是非极性分子而硫化羰是极性分子
B.二氧化碳与硫化羰均无还原性
C.固体硫化羰是原子晶体
D.硫化羰是一种酸性氧化物
5、下列说法正确的是
A.含有金属阳离子的晶体一定是离子晶体
B.只有在原子中,质子数才与电子数相等
C.非金属元素组成的化合物,一定是共价化合物
D.液态氯化氢不导电
4、下列各组物质的熔点变化规律,与它们的化学键无关的是
A.F2、Cl2、Br2、I2的熔点依次升高
B.Li、Na、K、Rb的熔点依次降低
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.晶体硅、碳化硅、金刚石的熔点依次升高
3、下列说法正确的是
A.明矾净水过程中不涉及化学变化
B.由同种元素组成的物质一定是纯净物
C.风化、石油分馏和碘的升华都是物理变化
D.在化学反应中,反应前后原子种类、数目和质量一定不变
2、用nA表示阿伏加德罗常数的值,下列叙述正确的是
A.1 mol -CH3和1 mol OH- 都含有10 nA个电子
B.标准状况下3.36 L CCl4含碳原子数为0.15nA
C.2 molHF溶于水配成溶液中含F- 2nA
D.46gNO2和N2O4混合气体中含氧原子数为2nA
1、北京奥运会 “水立方” 游泳池中的水主要是通过砂滤、臭氧和活性炭来净化的,下列有
关说法不正确的是
A.砂滤是利用过滤原理除去水中较大的固体颗粒
B.臭氧可以消毒杀菌是因为臭氧有强氧化性
C.游泳池水中的臭氧浓度越大越好
D.活性炭可以吸附水中悬浮的杂质
25.(9分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2 。
用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________。
⑵ 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
⑶ 滴定终点的现象是___________________________________________________。
⑷ 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为________________________。
⑸判断下列操作对TiO2质量分数测定结果的影响(填 偏高、偏低或无影响)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结
果_ _。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
八一中学2009-2010学年度第二学期期末
24.(4分) 加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为 ;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极 ,阳极
23.(9分) 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置, (1)写出电解饱和氯化钠溶液时,总离子反应方程式:
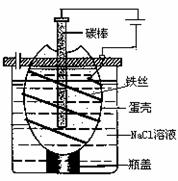 _______
_____
__。
(2) 下列有关说法正确的是
_______
_____
__。
(2) 下列有关说法正确的是
A.电解一段时间后,往蛋壳内溶液中滴加几滴
紫色石蕊试液,先变红后又褪色
B.蛋壳表面缠绕铁丝发生氧化反应
C.为增强导电性,可将石墨棒换成铜电极
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠
溶液接触 (3) 电解200 mL 0.5 mol/L的NaCl溶液,在标准状况下,阴极收集到2.24 L气体时,
阳极产生的气体为 L,常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为 ;若将阳极生成的气体通入电解后的溶液中,反应的离子方程式为 ,充分反应后,则所得溶液中阴离子的浓度由大到小依次是__________________。
(4)若将电解后阳极所产生的气体全部通入1 mol/L 500 mL Na2SO3的溶液中,使之充分反应(假设溶液的体积变化忽略不计),则所得溶液中SO42-的物质的量浓度最多为________ mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com