
题目列表(包括答案和解析)
4.串联电路中的四个电解池分别装有0.1mol·L-1的下列溶液,用惰性电极电解一段时间后,溶液的pH增大的是( )
A.NaNO3 B.H2SO4 C.AgNO3 D.KCl
3.以下现象与电化腐蚀无关的是 ( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
2.下列反应的离子方程式书写正确的是( )
A.足量铁屑溶于稀硝酸: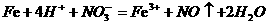
B.铝与氢氧化钾溶液反应: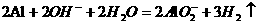
C.过氧化钠和水反应: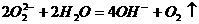
D.亚铁盐溶液中加入酸化的双氧水: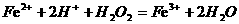
1.下列有关化学用语正确的是( )
A. 过氧化钠的电子式: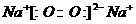

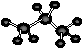 B. 丙烷分子的比例模型示意图:
B. 丙烷分子的比例模型示意图:
C. 乙烯的结构简式:CH2CH2
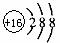
D. 结构示意图:
结构示意图:
22.(8分)实验室里常用浓盐酸跟高锰酸钾反应来制取少量氯气,反应的化学方程式为:2KMnO4 + 16HCl(浓)== 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
现用1L密度为1.19g/cm3、质量分数为36.5%的浓盐酸与一定质量的高锰酸钾反应,产生的氯气在标准状况下的体积为1.12L。
(1)计算反应中被氧化的HCl的物质的量。
(2)计算反应后溶液中H+的物质的量浓度。
高二新课程实施教学质量调研抽测
21、(16分)铁是人类较早使用的金属之一。运用铁的有关知识,回答下列问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是 nm
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式
。
检验反应后的溶液中还存在Fe3+的试剂是
(3)欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①蒸馏水
②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水⑦氯气,需要用到的试剂是 (填序号)
整个实验过程中涉及到的离子方程式
、
、 、
、
20.(13分)某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4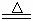 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
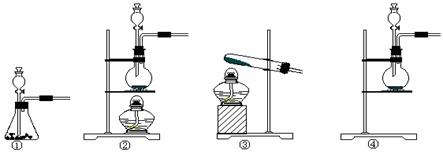
(2)该实验中A处可选用装置__________ _____ (填写装置的序号)。
(3)装置B中发生反应的离子方程式为________________________________________。
(4)装置C中的现象为___________________________________________________,
试结合反应方程式解释其原因 __________________________________ _
_________________________________ 。
(5)装置E中的试剂是______________(任填一种合适试剂的名称),其作用是________
_______________________________ ______。
(6)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验步骤)
_________________________________________________________________________
___________________________________________________ ______________
19.(18分)(1)标准状况下,44.8L的NH3气体质量为 g,其中含 个氮原子,其中含 mol 氢原子。
(2)标准状况下,11.2L的H2R气体质量为17g,则H2R的摩尔质量是 ,等质量的NH3与H2R的物质的量比为 ,1.7g氨气与 mol H2O含有的电子数相等。
(3)过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:
2Na2O2 + 2CO2 = 2Na2CO3 + O2 ; Na2O2 + CO = Na2CO3
试分别写出Na2O2与SO2、SO3反应的化学方程式:
(4)取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并写出相关的化学方程式:
①实验现象
②有关的化学方程式是 。
。
18.在实验室中,对下列事故或药品的处理正确的是
A、漂白粉长期放置在烧杯中
B、金属钠着火燃烧时,不能用泡沫灭火器灭火,应该用沙子灭火
C、氯水可以用无色透明的试剂瓶盛装保存
D、有大量的氯气泄漏时,用氢氧化钠溶液浸湿软布蒙面,并迅速离开现场
高二新课程实施教学质量调研抽测
化 学
第Ⅱ卷 非选择题(共55分)
16、要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A. ①③ B.③② C.③① D.①②③
17.科学的实验方法为我们探索物质世界提供了一把金钥匙。下列实验方法正确的是
A.两种互不相溶的液体,如汽油和水,可通过分液方法分离
B.因为碘易溶于酒精,所以常用酒精萃取碘水中的碘
C.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在瓷坩埚中加热熔化
D.不能用丁达尔效应鉴别Fe(OH)3胶体和CuSO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com