
题目列表(包括答案和解析)
17.(8分)四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如右图所示:
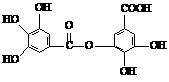 (1)1molA最多可与
mol NaOH反应。
(1)1molA最多可与
mol NaOH反应。
(2)A不具有的性质是 (填写序号)。
①与FeCl3溶液发生显色反应 ②加聚反应
③与溴水发生取代反应 ④与碳酸氢钠溶液反应生成二氧化碳
⑤与溴水发生加成反应
(3)有机化合物B在浓硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式
(4)有机化合物C是合成治疗禽流感药物的原料之一,C可以看成是B与氢气按物质的量之比
1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C与溴水反应的化学方程式: [来源:高&考%资(源#网]
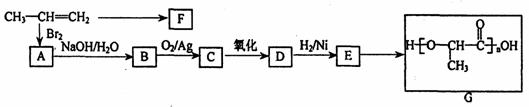 18.(8分)工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
18.(8分)工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
(1)聚合物F的结构简式是
(2)C与新制的Cu(OH)2共热转化为D的化学方程式是:
(3)D转化为E的化学方程式是
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是
16、将x mol Al2O3和y mol CuO混合后,全部溶于V L过量的稀硫酸中,然后向溶液中逐渐加入0.5 mol/L的NaOH溶液,当加入a L时,生成的沉淀最多,则原稀H2SO4的物质的量浓度为
A.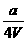 mol/L B.
mol/L B.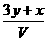 mol/L C.
mol/L C.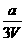 mol/L
D.无法计算
mol/L
D.无法计算
第II卷 非选择题(共52分)
15、某有机物A 是农药生产中的一种中间体,其结构简式如下。下列叙述中正确的是
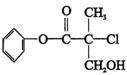 A.有机物A 属于芳香烃
B.有机物A 可以与Br2的CCl4溶液发生加成反应
A.有机物A 属于芳香烃
B.有机物A 可以与Br2的CCl4溶液发生加成反应
C.有机物A 与浓硫酸混合加热,可以发生消去反应
D.1 mo1A 与足量的NaOH 溶液反应,最多可以消耗3mol NaOH
14、氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电
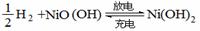 池的总反应为
。据此判断,下列叙述中正确的是
池的总反应为
。据此判断,下列叙述中正确的是
A.电池放电时,H2是正极
B.电池放电时,溶液中的阳离子移向正极
C.电池充电时,氢元素被氧化
D.电池放电时,电池负极周围溶液的pH不断增大
13、一定能在下列溶液中大量共存的离子组是
A.pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B.由水电离出的c(H+)=1×10-13mol / L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=14的溶液:Na+、K+、AlO2-、CO32-
12、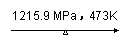 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程如下:
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程如下:
白磷 黑磷,黑磷比白磷稳定,结构与石墨相似。下列叙述正确的是
A.黑磷与白磷互为同分异构体 B.黑磷能导电
C.白磷转化为黑磷是氧化还原反应 D.白磷转化为黑磷是吸热反应
11、下列离子方程式正确的是
A.NaHCO3溶液中加入少量的石灰水 HCO3-+ Ca2+ + OH-=CaCO3↓+H2O
B.向氯化铁溶液中通入硫化氢气体 3Fe3+ + H2S = 2Fe2+ + FeS↓+2H+
C.氯化铝溶液中加入过量氨水 Al3+ + 4 OH- = AlO2-+ 2H2O
D.氨水中通入过量SO2 NH3·H2O + SO2 = HSO3- + NH4+
10、下列说法正确的是
A.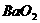 (过氧化钡)固体中的阴离子和阳离子之比为2∶1
(过氧化钡)固体中的阴离子和阳离子之比为2∶1
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HCl的相对分子质量大于HF,所以HCl的沸点高于HF
D.由ⅠA族和ⅥA族元素可形成原子个数比为1∶1、电子总数为38的化合物
9、为达到预期的实验目的,下列操作正确的是
A.配制0.1mol/L的盐酸500mL,应选用的仪器有胶头滴管、烧杯、玻璃棒、天平、500mL容量瓶
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.测定硫酸铜晶体中结晶水含量, 加热坩埚中晶体完全失水后需在空气中冷却,再称量
8、下列各组物质的分类正确的是
A.同位素:1H、D+、T2
B.电解质:H2O、CH3COOH、NH4HCO3
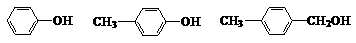 C.非极性分子:C60、CO2、CH2Cl2
C.非极性分子:C60、CO2、CH2Cl2
D.同系物: 、 、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com