
题目列表(包括答案和解析)
9.由于碳碳双键(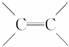 )不能自由旋转,因此
)不能自由旋转,因此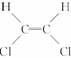 和
和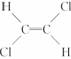 是两种不同的化合物,互为顺反异构体,则分子式为C4H8的烯烃的异构体有
是两种不同的化合物,互为顺反异构体,则分子式为C4H8的烯烃的异构体有
A.2种 B.3种 C.4种 D.5种
8.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是:
A.PE、PVC都属于链状高分子化合物,受热易熔化
B.PE、PVC的单体都是不饱和烃,能使溴水褪色
C.焚烧PVC保鲜膜会放出有毒气体如HCl
D.废弃的PE和PVC均可回收利用以减少白色污染
7.下列各组离子能在溶液中大量共存,且溶液呈碱性、透明的是:
A、Na+、OH-、HCO3-、NO3- B、AlO2-、K+、CO32-、Na+
C、Al3+、Cl-、CO32-、Na+ D、Fe2+、K+、H+、NO3-
6.据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是:
A、Fe -2e-=Fe2+ B、2H2O+O2+4e-=4OH-
C、2H++2e-=H2↑ D、4OH-- 4e-=2H2O+O2↑
5.下列情况与平衡移动无关的是:
A.用KClO3制取O2时,加入少MnO2 作为催化剂
B.滴加酚酞的氨水中加入氯化铵固体后红色变浅
C.FeCl3滴入沸水中,煮沸片刻得到红褐色胶体
D.加热后的纯碱水洗油污比冷碱水效果好
4.决定化学反应速率的主要因素是:
A.参加反应物质的性质 B.催化剂 C.浓度和压强 D.温度
3.某元素二价阴离子的核外有18个电子,质量数为32,该原子的原子核中的中子数为: A.12 B.14 C.16 D.18
2.下列关于纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是
|
|
纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
|
A |
大理石 |
玻璃 |
氯化钾 |
高氯酸 |
二氧化碳 |
|
B |
冰醋酸 |
漂白粉 |
小苏打 |
氟化氢 |
氨气 |
|
C |
明矾 |
硅酸盐水泥 |
苛性钠 |
亚硫酸 |
熟石灰 |
|
D |
纯盐酸 |
水煤气 |
硫酸 |
醋酸 |
氯气 |
1.已知热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH1=-483.6 kJ/mol,则对于热化学方程式:2H2O(l)===2H2(g)+O2(g) ΔH2=b,下列说法正确的是
A.热化学方程式中化学计量数表示分子个数
B.该反应的ΔH2=+483.6 kJ/mol
C.ΔH2<ΔH1
D.ΔH2>ΔH1
30(16分)丁香子醇结构简式如图: 。丁香子醇的一种同分异构体:对-甲
基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体。某校兴趣小组提出可以利用中学所学的简单有机物进行合成,A的产量标志着一个国家石油化工发展水平。其方案如下:
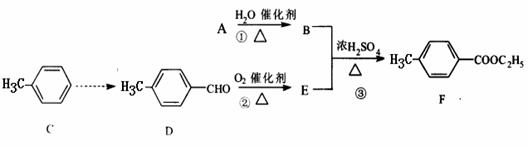
(1)写出丁香子醇的分子式 _____ 和含氧官能团的名称 _____ 。
(2)指出化学反应类型:① ;② 。
(3)下列物质不能与丁香子醇发生反应的是 (填序号)。
a.NaOH溶液 b.NaHCO3溶液 c.银氨溶液 d.乙酸
(4)写出反应③的化学反应方程式: ___________ 。
(5)写出符合下列条件:①含有苯环;②能够发生银镜反应的D的同分异构体:
______________________ ___________ 。(只答其中一种即可)
31(16分)(I)由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙醇的技术流程:
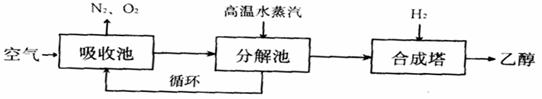
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变成可再生燃料乙醇。回答下列问题:
(1)写出吸收池中反应的离子方程式 __ 。
(2)工业上还采用以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g)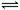 CH3CH2OH(g)+H2O(g)写出该反应的化学平衡常数表达式 K==
__;
CH3CH2OH(g)+H2O(g)写出该反应的化学平衡常数表达式 K==
__;
(II)自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g)
△H=-92.4kJ/mol
2NH3(g)
△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
_________________________________________________________________________。
(2)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.
计算:该条件下的平衡常数及N2的转化率?(写出计算过程)
32(24分)
(I)铜陵有色金属集团公司是电解铜产量全国第一的大型企业。其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程:
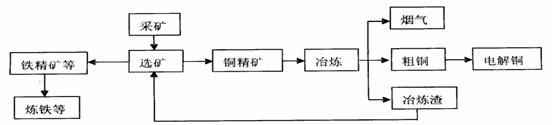
冶炼中的主要化学反应是:Cu2S+O2 2Cu+SO2
2Cu+SO2
(1)烟气中的主要废气是 .
(2)电解法精炼铜时,阳极是 __ (填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式沉淀在电解槽 ___ (填“阳极”或“阴极”)的槽底,阴极的电极反应式是 ___________________________。
(II)铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为____________________。从腐蚀废液回收得到金属铜还需要的试剂为_________________________。
(2)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是_____。(填字母)
|
选项 |
陈述I |
陈述II |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
I对;II对;无 |
|
C |
钢铁在中性环境易发生析氢腐蚀 |
钢铁发生电化学腐蚀均是铁被氧化成Fe3+ |
I错;II对;无 |
|
D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
I对;II对;有 |
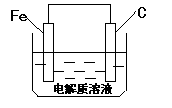 (3)钢铁的析氢腐蚀简单示意图如右,正极的电极反应式为
_______________________。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请直接在图中作出修改并标出电子流动方向。
(3)钢铁的析氢腐蚀简单示意图如右,正极的电极反应式为
_______________________。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请直接在图中作出修改并标出电子流动方向。
33(共8分)化学兴趣小组在实验室对粉末状Na2SO3样品是否变质进行探究,并希望用未变质的Na2SO3固体制取SO2,SO2在水中的溶解性为:1体积水约溶解40体积SO2。
限选实验仪器与试剂:白纸、Na2SO3样品、1 mol·L-1H2SO4、 12 mol·L-1H2SO4、6 mol·L-1HNO3、0.01 mol·L-1KMnO4、BaCl2溶液、品红试液、NaOH溶液、稀盐酸、 蒸馏水。
(1)请指出Na2SO3固体在空气中变质的原因,用化学方程式表示: _____________ 。
(2)请完成对Na2SO3样品是否变质的探究,提出合理假设:
假设1:Na2SO3样品完全没有变质;
假设2: ;
假设3: 。
① 设计实验方案证明你的假设(不要在答题卷上作答)
② 实验过程:根据假设方案,对假设2和假设3进行实验,判断Na2SO3样品是否变质。请在答题卷上按下表格式写出实验操作步骤、预期现象与结论。(可不填满)
|
实验操作 |
预期现象与结论 |
|
步骤1: |
|
|
步骤2: |
|
|
… |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com