
题目列表(包括答案和解析)
23. 下列化学反应的离子方程式正确的是
A. 将少量金属钠放人冷水中: Na + 2H2O = Na+ + 2OH- + H2↑
B. 将铝片加入烧碱溶液中: 2Al + 2OH-+ 2H2O = 2AlO2- + 3H2↑
C. 石灰石溶于醋酸:CaCO3 + 2CH3COOH == 2CH3COO-+ Ca2++ CO2↑+ H2O
D. 向澄清石灰水中通入过量二氧化碳:Ca2+ + 2OH- + CO2 = CaCO3↓ + H2O
22. 下列装置能达到实验目的的是
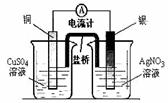
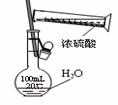
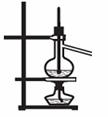
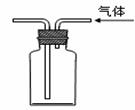
①② ③ ④ A.装置①将化学能转化为电能 B.图②用于稀释浓硫酸
C.装置③可用于石油分馏 D.装置④可用于收集氢气
12.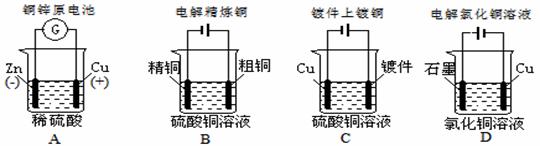 下列图示中关于铜电极的连接错误的是
下列图示中关于铜电极的连接错误的是
11.下列说法不正确的是
A.氯乙烯、聚乙烯、苯乙烯都是不饱和烃
B.蛋白质溶液中加入浓的硫酸铵溶液会有沉淀析出
C.苯能与溴在一定条件下发生取代反应
D.淀粉和纤维素水解的最终产物都是葡萄糖
10. 设nA为阿伏加德罗常数的数值,下列说法正确的是
A.0.1 mol.L-1 Mg(NO3)2溶液中含有0.2nA个NO3- B. 8 g CH4中含有10nA个电子
C. 常温常压下,22.4L O3中含有3nA个氧原子 D.28g C2H4中含有2nA个碳原子
9.已知在298K时下述反应的有关数据:
C(s) + 1/2 O2(g) = CO(g) △H1 =-110.5kJ/mol
C(s) + O2(g) = CO2(g) △H2=-393.5kJ/mol
则C(s)+CO2(g)== 2CO(g)的△H
A.283.5kJ/mol B.172.5kJ/mol C.-172.5kJ/mol D.-504 kJ/mol
8.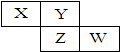 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。若Z原子的最外层电子数是K层电子数的3倍,下列说法中正确的是
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。若Z原子的最外层电子数是K层电子数的3倍,下列说法中正确的是
A.X的最常见气态氢化物的水溶液显酸性
B.最高价氧化物对应水化物的酸性W比Z强
C.Z的单质与氢气反应较Y剧烈 D.X的原子半径小于Y
7.下列无色溶液中的离子能大量共存的是
A.K+、Na+、MnO4-、SO42- B.H+、K+、NO3-、SO32-
C.Na+、Ba2+、Cl-、Br- D.Fe3+、NH4+、SCN-、HCO3-
22.(10分)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
 Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂。它与我们的生活密切相关。
Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂。它与我们的生活密切相关。
(1)H2O中心原子O的杂化轨道的类型为 。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
Ⅱ.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(3) 写出硫酸铜水溶液的试管里加入氨水生成沉淀的离子方程式_______________________,
(4) 实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。
A.极性键 B.非极性键 C.配位键 D.金属键 E.离子键
(5) 实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体,在该络合物中根据价层互斥理论可知SO42-空间形状为: 。
 “华安、连城、永安、漳平,龙海二中,泉港一中”六校联考
“华安、连城、永安、漳平,龙海二中,泉港一中”六校联考
2010-2011学年下学期第二次月考
21.(12分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语或符号回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
|
|
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
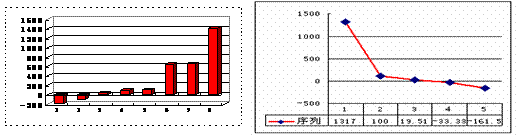
图(1) 图(2)
(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是 晶体(填晶体的类型)。
(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
序列“2”的氢化物的结构式为 。
(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是 (填选项序号)
A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目‘
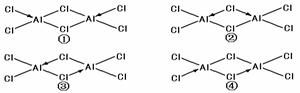 (4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是_______________。
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是_______________。
 (5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是_____________(选填序号)
(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是_____________(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如右图,晶胞中分摊2个钠原子
C.氮的电负性大于氧 D.Na+的半径小于N3-的半径
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com