
题目列表(包括答案和解析)
29、(6分) 氢氧化铜悬浊液中存在如下平衡:
Cu(OH)2 (s)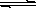 Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于 。
(2)除去CuCl2溶液中少量的Fe2+,可以按照下面的流程进行:
|
|||
|
|||



|

|
 调节pH
调节pH
已知Fe2+ 、Cu2+ 、Fe3+ 三种离子开始沉淀和完全沉淀时溶液pH值如下:
|
金属 离子 |
pH |
|
|
开始沉淀 |
完全沉淀 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Cu2+ |
4.4 |
6.4 |
|
Fe3+ |
2.7 |
3.7 |
①下列物质中适合作为试剂X的是( )
A.H2O2 B.KMnO4 C.HNO3 D.Cl2
②加入的Y及调节的pH范围是( )
A.CuCO3 3.7-4.3 B.CuO 3.7-6.4
C.NaOH 3.7-4.2 D.NH3·H2O 3.7-4.0
28、(7分)25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)。(填“>”、“<”、“=”)
(2)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)= mol·L-1
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH 7 (填“>”、“<”、“=”)
(4)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列 (填序号)
27、(10分)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0 试回答下列问题:
CO2(g)+H2(g) △H<0 试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=
(2)在相同温度下,起始物质按下列四种配比充入该容器中,c(H2O)=2mol·L-1 ,c(CO)=c(CO2)=1 mol·L-1, c(H2)=1.5 mol·L-1 ,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”、“小于”或“等于”)。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
26、(9分)完成以下小题:
(1)已知NaHSO3溶液显酸性,则溶液中各离子浓度从大到小的顺序是
。
(2)25℃时,向pH=4的NaHSO4溶液中,逐滴加入pH=9的Ba(OH)2溶液至中性,则该过程的离子反应方程式 ;已知25℃时BaSO4的Ksp=1.0×10-10,则以上过程中 沉淀生成(填“有” 或“无”) 。
(3)某温度下,0.1 mol·L-1Na2CO3溶液中c(Na+)∕c(CO32-)=20/9,其原因是 ;现往Na2CO3溶液中通入一定量的CO2后,c(Na+)∕c(CO32-)=5∕2,其原因是 。(用离子方程式和必要的文字说明)
25、下列物质的溶液加热蒸干、灼烧后,所得的固体成份不相同的是( )A.FeCl2、FeCl3 B.NaHCO3、Na2CO3
C.Al2(SO4)3、AlCl3 D.Mg(HCO3)2、MgCl2
第Ⅱ卷(非选择题,共50分)
24、草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42 -)+c(HC2O4- )
C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
23、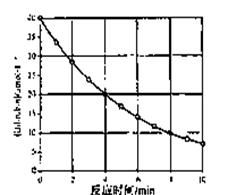 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物尝试随反应时间变化如右图所示,计算反应4~8 min间的平均反应速率和推测反应16 min 反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物尝试随反应时间变化如右图所示,计算反应4~8 min间的平均反应速率和推测反应16 min 反应物的浓度,结果应是( )
A.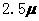 mol·L-1·min-1和
mol·L-1·min-1和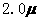 mol·L-1
mol·L-1
B.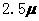 mol·L-1·min-1和
mol·L-1·min-1和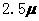 mol·L-1
mol·L-1
|
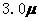 mol·L-1·min-1和
mol·L-1·min-1和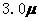 mol·L-1
mol·L-1
D.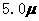 mol·L-1·min-1和
mol·L-1·min-1和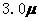 mol·L-1
mol·L-1
22、25℃时,水的电离达到平衡:H2O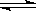 H++OH-;ΔH>0,下列叙述正确的是( )
H++OH-;ΔH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
21、把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:
Ca(OH)2(s) Ca2++2OH-下列说法正确的是( )
Ca2++2OH-下列说法正确的是( )
A.恒温下向溶液中加CaO,溶液的pH升高 B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加 D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
20、已知一种c(H+)=1×10-3 mol·L-1的酸和一种c(OH-)=1×10-3 mol·L-1碱溶液,等体积混合后溶液呈酸性,其原因可能是( )
A.浓的强酸和稀的强碱溶液反应 B. 浓的弱酸和稀的强碱溶液反应
C.等浓度的弱碱和强酸溶液反应 D. 生成了一种强酸弱碱盐
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com