
题目列表(包括答案和解析)
2.以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1molH3O+中含有NA个电子
B.标准状况下,11.2L臭氧中含有NA个氧原子
C.1.8g重氧水(H218O)含有NA个中子
D.84gNaHCO3晶体中含有NA个CO32-
1.下列叙述正确的是
A.离子晶体中只存在离子键
B.原子晶体中只存在非极性共价键
C.冰是水分子间主要通过氢键作用有规则排列成的分子晶体
D.液态氧化钠和铜导线的导电原理是相同的
26.(8分)某化工厂在硫黄矿为原料生产硫酸。若空气中氧气的体积分数按20%计算且不考虑各生产阶段的物质损失,回答下列问题。
 (1)已知2SO2(g)+O2(g) 2SO3(g),△H<0。生产中,为了提高SO2的转化率,
(1)已知2SO2(g)+O2(g) 2SO3(g),△H<0。生产中,为了提高SO2的转化率,
依据化学平衡原理所确定的条件或措施有 (填序号)。
a.原料在进入焚硫炉之前先粉碎 b.使用V2O5做催化剂
c.接触室中不使用很高的温度 d.用过量的空气跟SO2反应
e.接触氧化在常压下进行
(2)如果生产98%的硫酸10t,需要原料硫黄的质量为 t,需要消耗空气的体积(标准状况)为 m3。
(3)该厂每天消耗空气2.24×104m3(标准状况),生产98%的硫酸a t。若在SO2催化氧化时不再补充空气,并假设生产过程中硫酸的产率为100%,当硫燃烧后的混合气体中氧气的体积分数为b时,a= (用b表示),b的取值范围是
。
25.(4分)某有机物R完全燃烧产物只有CO2和H2O。已知1mol R完全燃烧时,生成n molCO2,消耗1.5n molO2。试回答下列问题。
(1)若R为烃,则R的分子式为 。
(2)若R为烃的含氧衍生物,3.0g R与足量金属钠反应生成560 mL(标准状况)H2,则R的分子式为 。
23.(8分)化学工作者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐
患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。


 (1)工业上用乙烯和氯气为原料经下列各步合成PVC:
(1)工业上用乙烯和氯气为原料经下列各步合成PVC:
乙烯 甲 乙 PVC
乙是PVC的单体,其结构简式为 ,反应①、③的化学方程
式分别为 、
。
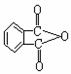 (2)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐
(2)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐
( )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP
(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为 。
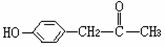 24.(9分)有机物X、Y、Z都是芳香族化合物,X与Z互为同分异构体,X的分子式为C9H8O,
24.(9分)有机物X、Y、Z都是芳香族化合物,X与Z互为同分异构体,X的分子式为C9H8O,
试回答下列问题。
(1)X是一种重要的医药中间体,结构简式为 ,可能发生的
反应有 。
a.取代反应 b.消去反应 c.氧化反应 d.水解反应
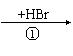
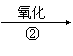
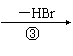
(2)有机物Y有如下转化关系:Y B C A
其中Y不能跟金属钠反应;A能跟NaHCO3溶液反应,能使溴的四氧化碳溶液褪色,
且苯环上只有一个取代基。
Y的结构简式为 或 。
(3)Z可由A经一步反应制得。
①Z的结构简式为 或 ;
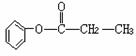 ②Z有多种同分异构体,其中属于饱和脂肪酸的酯类,且苯环上只有一个侧链的同
②Z有多种同分异构体,其中属于饱和脂肪酸的酯类,且苯环上只有一个侧链的同
分异构体有 、 、
、 。
22.(8分)A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X
或一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元
素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。
试回答下列问题:
(1)A、B的元素符号分别为 、 。
(2)写出Y水解的离子方程式 。
(3)将9gB单质在空气中充分燃烧,所得气体通入1L 1mol/LNaOH溶液中,完全吸收
后,溶液中各离子浓度由大到小的顺序是 。
(4)在101kPa时,1gX气体在D单质中充分燃烧,生成一种液态化合物和另一种对环
境无污染的稳定物质,放出18.6kJ的热量。该反应的热化学方程式为
。
21.(6分)神舟6号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料
是偏二甲肼[(CH3)2N-NH2],氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是 ,产生该气体的化学反应方程式
为 。
(2)偏二甲肼在N2O4中燃烧的化学方程式为 ,
当有1mol偏二甲肼燃烧时,转移电子的物质的量为 。
20.(5分)已知某溶液中只含有OH-、H-、Na+、CH3COO-四种离子。
(1)若溶液中只溶解了一种溶质,则该溶质是 。
(2)若溶液中c(CH6COO-)>c(H+)>c(H+)>c(OH-),则含有的溶质是
。
(3)若溶液是由体积相等的NaOH溶液和CH3COOH溶液混合而成, 恰好呈中性,则
混合前c(CH3COOH) c(NaOH)(填“<”“>”或“=”)。
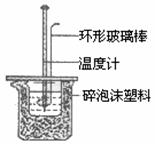
19.(8分)实验室用50mL 0.5mol/L盐酸、50mL 0.55mol/LNaOH溶液在下图所示装置进行
 测定中和热的实验,得到表中的数据:
测定中和热的实验,得到表中的数据:
|
实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
请回答下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是 ,
不能用铜丝搅拌棒代替环形玻璃棒的理由是 。
(2)经数据处理,t2-t1=3.4℃。则该实验测得的中和热△H= [盐酸和NaOH溶
液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与
△H的关系为:△H1 △H(填“<”、“>”或“=”),理由是
。
18.取ag某物质A,在氧气中完全燃烧,使燃烧产物跟足量过氧化钠反应,反应后固体的质
量增加了bg。若b>a,则A为 ( )
A.H2 B.CO C.C12H22O11 D.C6H12O6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com