
9.氨溶于水的喷泉实验可以证明
A.氨气比空气轻 B.氨气有刺激性气味
C.氨气不稳定 D.氨气易溶于水
8.在短周期元素中,原子最外电子层只有1个或2个电子的元素是
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
7.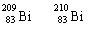 铋(Bi)在医药方面有重要应用。下列关于 和 的说法中,不正确的是
铋(Bi)在医药方面有重要应用。下列关于 和 的说法中,不正确的是
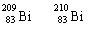
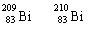 A. 和 都含有83个质子 B. 和 互为同位素
A. 和 都含有83个质子 B. 和 互为同位素
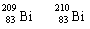
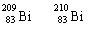 C. 和 的核外电子数相同 D. 和 分别有209和210个中子
C. 和 的核外电子数相同 D. 和 分别有209和210个中子
6. 下列叙述不正确的是
下列叙述不正确的是
A.断开化学键要吸收能量 B.元素的化合价 = 元素原子的最外层电子数
C.原子的核电荷数 = 原子序数
D. 共价化合物中不可能有离子键
共价化合物中不可能有离子键
5.下列化合物中,同时含有离子键、共价键的是
A. NaOH B. H2O2 C. HCl D. NaCl
4.以下反应属于吸热反应的是:
A.锌与稀硫酸的反应 B.氯化铵与氢氧化钡晶体反应
C.煤的 燃烧
D. 氢氧化钠与盐酸的反应
燃烧
D. 氢氧化钠与盐酸的反应
3.检验氨气可以用
A.湿润的红色石蕊试纸
B.干燥的红 色石蕊试纸
色石蕊试纸
C.干燥的蓝色石蕊试纸 D.湿润的蓝色石蕊试纸
2.以下对元素周期表的说法不正确的是
A.有七个周期 B.有 18个族 C.有三个短周期
D.有7个主族
18个族 C.有三个短周期
D.有7个主族
一、单项选择题
1.下列气体不属于大气污染的是
A.二氧化碳 B.一氧化氮 C.二氧化硫 D.二氧化氮
4.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5 ℃。
(1)在锅炉水中加入N2H4,可以把锅炉表面的氧化铁还原为结构紧密的四氧化三铁保护层,请配平下列反应方程式:
______Fe2O3+______N2H4―→____Fe3O4+____N2↑+______H2O
(2)肼燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。常温下,若肼的燃烧热为Q kJ/mol,写出表示肼燃烧热的热化学方程式:_____________________________________。
(3)肼—空气燃料电池是一种碱性燃料电池,肼可转化为氮气与水。常用的电解质溶液为20%~30%的KOH溶液。该电池放电时,负极的电极反应式是__________________________。
(4)肼易溶于水,它是一种二元弱碱,已知:在相同条件下N2H4·2H2O的电离程度大于N2H的水解程度。常温下,若0.2 mol/L N2H4·2H2O溶液与0.1 mol/L盐酸等体积混合,则溶液中N2H、Cl-、OH-、H+的浓度由大到小的顺序为____________。
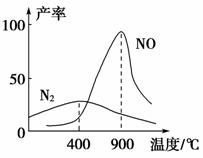
(5)肼和氧气在不同温度和催化剂条件下生成不同的产物(如图所示),温度较高时主要发生反应N2H4(g)+2O2(g)2NO(g)+2H2O(g),若此反应1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1________K2(填“>”、“<”或“=”)。1 000 ℃时,反应达到平衡,下列措施中能使增大的是________(填序号)。
A.恒容条件下,充入He气
B.增大容器体积
C.恒容条件下,充入N2H4
D.使用催化剂
[解析] (1)根据电子守恒配平方程式。(2)注意表示燃烧热的热化学方程式中,可燃物的计量数为1。(3)注意电解质溶液为碱性,电极反应式中不能生成H+而是生成H2O。(4)由题意知肼是一种二元弱碱,常温下,0.2mol/L N2H4·
2H2O溶液与0.1
mol/L盐酸等体积混合,完全反应后所得的溶液为等物质的量浓度的N2H5Cl和N2H4·2H2O的混合溶液,又知N2H4·2H2O的电离程度大于N2H的水解程度,故溶液呈碱性,且N2H的浓度大于Cl-的浓度,故c(N2H)>c(Cl-)>c(OH-)>c(H+)。(5)由题意知肼可作火箭燃料,其与氧气发生的反应为N2H4+2O2 2NO+2H2O,由图可知温度大于900 ℃时温度越高,产物产率越低,平衡常数越小。该反应为气体体积增大的反应,故增大容器体积或恒容条件下充入N2H4均可使平衡右移,增大;而恒容条件下充入惰性气体与使用催化剂均不能影响化学平衡。
2NO+2H2O,由图可知温度大于900 ℃时温度越高,产物产率越低,平衡常数越小。该反应为气体体积增大的反应,故增大容器体积或恒容条件下充入N2H4均可使平衡右移,增大;而恒容条件下充入惰性气体与使用催化剂均不能影响化学平衡。
[答案] (1)6 1 4 1 2
(2)N2H4(l)+O2(g)===N2(g)+2H2O(l)
ΔH=-Q kJ/mol
(3)N2H4-4e-+4OH-===N2↑+4H2O
(4)c(N2H)>c(Cl-)>c(OH-)>c(H+)
(5)> BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com