
3.对于恒温、恒压条件下的可逆反应(体积可变的反应或体积不变的反应)
如果按方程式的化学计量关系转化为方程式同一半边的物质,其物质的量比与对应组分的起始加入量比相同,则建立的化学平衡状态是等效的。
[注意] 三种情况下的等效均指的是平衡混合物中各组分的百分含量保持不变。实际上三种等效是有差别的,第(1)种情况是绝对等效(包括浓度、密度、平均相对分子质量等都相等),而在第(2)、(3)种情况下,物质的量等存在倍数关系。
 在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应A(g)+2B(g)
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应A(g)+2B(g)
 3C(g),已知加入1
mol A和3 mol B,且达到平衡后,生成a mol C。
3C(g),已知加入1
mol A和3 mol B,且达到平衡后,生成a mol C。
(1)达到平衡时,C在混合气体中的体积分数是________(用字母a表示)。
(2)在相同的实验条件下,若加入2 mol A和6 mol B,达到平衡后,C的物质的量为________ mol(用字母a表示),此时C在反应混合气体中的质量分数________(填“增大”、“减小”或“不变”)。
(3)在相同实验条件下,若改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气体中的质量分数不变,则还应加入C________ mol。
[解析] (1)由于该反应是等体积反应,n总=n平=4 mol,==。
(2)物质按比例增多,相当于对体系加压,平衡不移动,故质量分数不变。
(3)根据等效平衡原理,设还应加入C x mol,则
(2+)∶(8+x)=1∶3,
解得x=6。
[答案] (1) (2)2a 不变 (3)6

2.对于恒温、恒容条件下体积不变的反应
如果按方程式的化学计量关系转化为方程式同一半边的物质,其物质的量比与对应组分的起始加入量比相同,则建立的化学平衡状态是等效的。例如
H2(g) + I2(g)  2HI(g)
2HI(g)
①1 mol 1 mol 0 mol
②2 mol 2 mol 1 mol
上述两种配比,按方程式中化学计量关系均转化为反应物,两种情况下H2(g)与I2(g)的物质的量比均为1∶1,因此上述两种情况下建立的化学平衡状态是等效的。
二、等效平衡
1.对于恒温、恒容条件下体积可变的反应
如果按方程式的化学计量关系转化为方程式同一半边的物质,其物质的量与对应组分的起始加入量相同,则建立的化学平衡状态是等效的。如可逆反应
2SO2 + O2 2SO3
2SO3
①2 mol 1 mol 0 mol
②0 mol 0 mol 2 mol
③0.5 mol 0.25 mol 1.5 mol
上述三种配比,按方程式的化学计量关系均转化为反应物,则SO2均为2 mol、O2均为1 mol,三者建立的平衡状态完全相同。
2.常见图像类型
对于反应mA(g)+nB(g) pC(g)+qD(g) ΔH<0,m+n>p+q。
pC(g)+qD(g) ΔH<0,m+n>p+q。
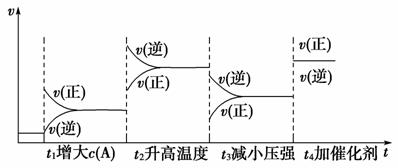
(1)vt图象
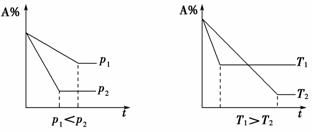
(2)c(或百分含量)t图象
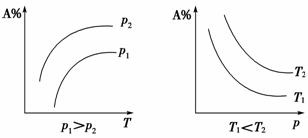
(3)c(或百分含量)p(T)图象
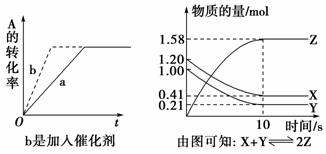
(4)其他图象
(5)几种特殊图象
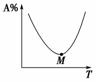
①如右图,对于化学反应mA(g)+nB(g) qC(g)+pD(g),M点前,表示从反应物开始,则v(正)>v(逆);M点为刚好达到平衡点。M点后为平衡受温度的影响情况,即升温,A%增加,平衡左移,ΔH<0。
qC(g)+pD(g),M点前,表示从反应物开始,则v(正)>v(逆);M点为刚好达到平衡点。M点后为平衡受温度的影响情况,即升温,A%增加,平衡左移,ΔH<0。
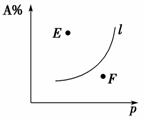
②如右图,对于化学反应mA(g)+nB(g) qC(g)+pD(g),l线上所有的点都是平衡点。在上方(E点),A%大于此压强时平衡体系中的A%,所以,E点v(正)>v(逆);在下方(F点),A%小于此压强时平衡体系中的A%,则v(正)<v(逆)。
qC(g)+pD(g),l线上所有的点都是平衡点。在上方(E点),A%大于此压强时平衡体系中的A%,所以,E点v(正)>v(逆);在下方(F点),A%小于此压强时平衡体系中的A%,则v(正)<v(逆)。
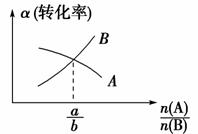
③如右图,对于aA(g)+bB(g) cC(g)反应,n(A)、n(B)是A、B的物质的量,交点n(A)∶n(B)=a∶b。
cC(g)反应,n(A)、n(B)是A、B的物质的量,交点n(A)∶n(B)=a∶b。
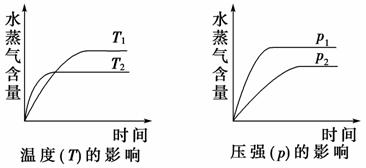
 (2011·重庆高考)一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
(2011·重庆高考)一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
B.CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
C.CH3CH2OH(g) CH2===CH2(g)+H2O(g) ΔH>0
CH2===CH2(g)+H2O(g) ΔH>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
2C6H5CH===CH2(g)+2H2O(g) ΔH<0
[解析] 观察图象可知,达到平衡用的时间短反应速率快,T2>T1、p1>p2。升高温度水蒸气的百分含量降低,说明平衡逆向移动,正反应放热,ΔH<0;增大压强水蒸气的百分含量增大,说明平衡正向移动,正反应气体分子数减少,综合分析A选项中反应符合要求。
[答案] A
 (2013·浙江高考)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
(2013·浙江高考)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq)
(NH4)2CO3(aq)
ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq)
NH4HCO3(aq)
ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
请回答下列问题:
(1)ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________。
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①ΔH3________0(填“>”“=”或“<”)。
②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是_______________。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化总趋势曲线。
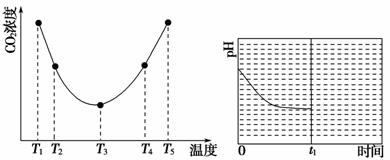
图1 图2
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有_________(写出2个)。
[解析] 结合题给图象,用盖斯定律、化学平衡原理作理论指导进行分析、解决相关问题。
(1)根据盖斯定律,由反应Ⅱ×2减反应Ⅰ可得:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq),则有ΔH3=2ΔH2-ΔH1。
2NH4HCO3(aq),则有ΔH3=2ΔH2-ΔH1。
(2)①由图1可知,当温度为T3时,可逆反应达到平衡状态,温度升高,CO2的浓度逐渐增大,说明平衡逆向移动,正反应为放热反应,则有ΔH3<0。
②在T1~T2区间,此时可逆反应未达到平衡,温度升高,化学反应速率加快,平衡正向移动,CO2的捕获量随温度的升高而提高。在T4~T5区间,此时可逆反应已达到平衡状态,由于该反应为放热反应,温度升高,平衡逆向移动,CO2的捕获量随温度的升高而降低。
③t1时刻,温度迅速升高到T2,平衡逆向移动,溶液的pH升高,根据化学平衡移动原理,达到新平衡时,溶液的pH低于开始时的pH。
(3)欲提高CO2的吸收量,应使平衡正向移动,可降低温度或增加CO2的浓度等。
[答案] (1)2ΔH2-ΔH1
(2)①<
②T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高。T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2捕获
(3)降低温度;增加CO2浓度(或分压)
一、化学反应速率和平衡图象
1.一般解题思路


解答化学平衡图象问题应注意
①曲线上的点是不是表示平衡状态。一般横坐标是时间的曲线,曲线上的点不一定都表示平衡状态;横坐标是温度或压强的曲线,曲线上的点一般表示平衡状态,这些点之间的关系反映了化学平衡的移动情况。
②先拐先平:在转化率-时间的曲线中,先出现拐点的曲线先达到平衡(代表温度高、压强大或加入催化剂)。
③定一议二:当图象中有三个量时,先假设其中一个量不变,再讨论另外两个量的关系。
45.(5分)某工厂的废液中含有NaCl和NaNO3两种溶质,为测定其含量以方便回收利用,人们进行了如下实验:已知:AgNO3 + NaCl ═ AgCl↓+ NaNO3。
(1)取10g废液放入蒸发皿中蒸干,得到固体4.94g。
(2)再取50g废液放入烧杯中,向其中加入AgNO3溶液直到不再产生沉淀为止,共消耗AgNO3溶液128.7g,反应后过滤,测得滤液中溶质的质量分数为20%。
请计算出废液中NaCl的质量分数。
四、计算题
44.(5分)发射“嫦娥一号”的火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,其完全反应的化学方程式:C2H8N2 + 2N2O4 点燃 3N2 + 2CO2 + 4H2O,若燃烧3t偏二甲肼,试求消耗四氧化二氮的质量是多少?
43.(9分)某同学设计如下实验,测定某品牌碳酸饮料中CO2的含量,并对用氢氧化钠溶液溶液吸收CO2后的溶液中溶质的成分进行研究。
实验一:测定某品牌碳酸饮料中的CO2的含量。
①将250mL瓶装碳酸饮料放在冰箱中冷冻一段时间(未结冰);
②将饮料从冰箱内取出,迅速加入质量分数为50%NaOH溶液5mL;倒转饮料瓶,轻轻震荡,然后放置恢复至室温,作待测液;
③按下图连接实验装置。取50mL待测液置于装置B的锥形瓶中,关闭 开关K,打开分液漏斗的活塞,向锥形瓶中注入稀硫酸,至不再产生气泡,关闭活塞;
开关K,打开分液漏斗的活塞,向锥形瓶中注入稀硫酸,至不再产生气泡,关闭活塞;
④打开开关K,向装置中鼓入空气,一段时间后,将C装置中的物质过滤,洗涤,烘干称量质量为0.39 4g。
4g。
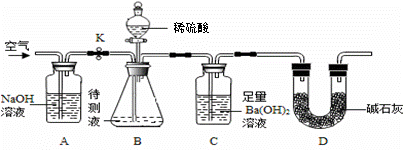
资料:①CO2与足量Ba(OH)2反应生成BaCO3沉淀。②NaHCO3与盐酸反应生成CO2 。
③实验中各种溶液的密度都视为1g/mL。碱石灰是CaO与NaOH的固体混合物。
(1)上述实验过程中,C装置中的现象是 。
(2)装置A中发生的化学反应方程式为 ,装置D的目的是 。
(3)步骤①冷冻碳酸饮料的目的是 。
(4)步骤④鼓入空气的目的是 。
(5)根据题中提供的数据计算此品牌碳酸饮料中CO2的含量为 g/L。(加入的NaOH溶液的体积可忽略不计)
实验二:探究待测液中溶质的成分。
根据质量守恒定律,同学们对待测液中还可能存在其它溶质作出如下猜想:
①Na2CO3 ②NaHCO3 ③Na2CO3、NaHCO3 ④NaOH、Na2CO3
⑤NaOH、NaHCO3 ⑥NaOH、Na2CO3、NaHCO3
资料:①氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;氯化钙溶液
与碳酸溶液混合后发生如下反应:Na2CO3+CaCl2═CaCO3↓+2NaCl;氯化钙溶液与NaOH
溶液混合后发生如下反应:2NaOH+CaCl2═Ca(OH)2↓+2NaCl
②NaHCO3溶液呈碱性;碳酸氢钠、碳酸钠分别与足量的酸反应产物相同。
实验验证:
(1)取少量待测液于试管中,加入足量的稀盐酸,有大量气泡产生。
(2)另取少量待测液于试管中,加入足量的氯 化钙溶液,若
,则猜想②正确。请说明理由:
。
化钙溶液,若
,则猜想②正确。请说明理由:
。
42.(9分)下面是利用右图装置完成验证二氧化碳性质的实验。
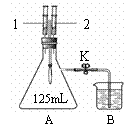 (1)注射器1中盛有10mL水,注射器2中盛有10mL石蕊溶液,A中充满CO2,B中盛有NaOH溶液。先将K关闭,推注射器1向A中注入水,一段时间后,看到气球变鼓,再将注射器2中石蕊溶液注入A中,看到的现象是 ,产生上述现象的原因是 ;最后,打开K,看到的现象是
。
(1)注射器1中盛有10mL水,注射器2中盛有10mL石蕊溶液,A中充满CO2,B中盛有NaOH溶液。先将K关闭,推注射器1向A中注入水,一段时间后,看到气球变鼓,再将注射器2中石蕊溶液注入A中,看到的现象是 ,产生上述现象的原因是 ;最后,打开K,看到的现象是
。
(2)注射器1中盛有5mL的石灰水,注射器2中盛有10mLNaOH溶液,A中充满CO2,B中盛有稀盐酸(通常状况下,1体积的水约能溶解1体积二氧化碳)。
①关闭K,将注射器2中的10mLNaOH溶液注入A中,轻轻振摇,看到的现象是 ,甲同学说此现象不能证明CO2和NaOH发生了反应。于是甲同学提出了猜想:上述实验后,可以向外拉动注射器1,如果看到 现象,则证明CO2和NaOH发生了反应。
②对甲同学的猜想,乙同意认为不够准确,原因是 。乙同学认为,只需打开止水夹K就能证明CO2和NaOH发生了反应, 则A中观察到的现象是 ,请写出此实验中能证明实验结论的化学反应方程式 。
三、实验题
41.(7分)根据下图所示制备气体的装置,回答下列问题(装置选择可用序号填写)。

A B C D E
(1)标有字母a的仪器名称是 。
(2)实验室用大理石和稀盐酸制取二氧化碳时,其反应的化学方程式为 ,收集装置是 。
(3)实验室用高锰酸钾制取氧气时,应选用的发生装置是  ,有关反应的化学方程式为 。用带火星的木条检验氧气时,可观察到的现象是 。将点燃的铁丝伸入氧气瓶中,看到铁丝剧烈燃烧,火星四射,发生反应的化学方程式为 。
,有关反应的化学方程式为 。用带火星的木条检验氧气时,可观察到的现象是 。将点燃的铁丝伸入氧气瓶中,看到铁丝剧烈燃烧,火星四射,发生反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com