
3.(2013·天津高考)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+ 2H2O(l)
电解池:2Al+3H2OAl2O3+3H2↑
电解过程中,以下判断正确的是( )
|
|
电池 |
电解池 |
|
A |
H+移向Pb电极 |
H+移向Pb电极 |
|
B |
每消耗3
mol Pb |
生成2
mol Al2O3 |
|
C |
正极:PbO2+4H++2e-===Pb2++2H2O |
阳极:2Al+3H2O-6e-===Al2O3+6H+ |
|
D |
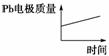 |
 |
[解析] 原电池中,Pb为负极:Pb-2e-+SO===PbSO4,PbO2为正极:PbO2+2e-+SO+4H+===PbSO4+2H2O,所以H+向PbO2极移动。电解池中,Pb为阴极:2H++2e-===H2↑,Al为阳极:3H2O+2Al-6e-===Al2O3+6H+,所以H+向Pb电极移动,A错。每消耗3 mol Pb时转移6 mol e-,每生成2 mol Al2O3时,转移12 mol e-,B错。根据A项分析,可知电池的正极反应式书写错误,C错。原电池中随时间增长,Pb变为PbSO4,质量增加,电解池中Pb极产生H2,Pb电极质量不变,D正确。
[答案] D
2.用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。
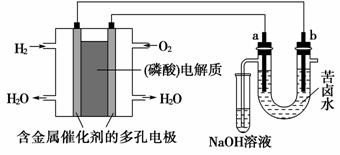
下列说法中,正确的是( )
A.电池工作时,正极反应式为:O2+2H2O+4e-===4OH-
B.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C.电解时,电子流动的路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02 g H2时,a极周围会产生0.71 g Cl2
[解析] A项忽视了在酸性环境中不可能生成OH-;电解时阳极发生失电子氧化反应,还原性强的离子优先失电子,a极产物应首先得到Br2,其次才能得到Cl2,故B项正确,而D项错误;电解时,电子不是通过溶液转移,而是通过溶液中的离子放电(阴离子失电子或阳离子得电子)转移的,C项错误。
[答案] B
1.
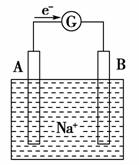
美国能源部西北太平洋国家实验室的科学家和来自中国武汉大学访问学者组成的研究小组合作开发钠离子充电电池,研究人员利用廉价的钠离子,同时使用纳米氧化锰和锂材料作电极制作出了钠离子充电电池,其工作原理示意图如图所示。下列关于该电池的说法中正确的是( )
A.放电时A极作正极
B.放电时Na+向负极移动
C.充电时是将化学能转化为电能
D.放电时负极反应式为Li-e-===Li+
[解析] 放电时A极失电子,作负极,放电时Na+向正极移动,A、B错;充电时是将电能转化为化学能,C错。
[答案] D
3.溶液中离子移动方向的判断
放电时,阴离子移向负极,阳离子移向正极;充电时,阴离子移向阳极,阳离子移向阴极。
 美国麻省理工学院的丹尼尔·诺切拉博士公布了自己团队研发的“人造树叶”,它可以与燃料电池共同构成一个新的发电装置——太阳能燃料电池,工作原理如图所示,下列有关叙述正确的是( )
美国麻省理工学院的丹尼尔·诺切拉博士公布了自己团队研发的“人造树叶”,它可以与燃料电池共同构成一个新的发电装置——太阳能燃料电池,工作原理如图所示,下列有关叙述正确的是( )
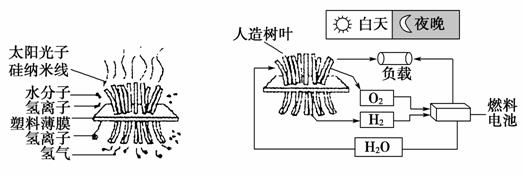
图A “人造树叶”工作原理示意图 图B 太阳能燃料电池工作示意图
A.“人造树叶”上发生的反应为6CO2+6H2OC6H12O6+6O2
B.图A中塑料薄膜上部的反应为2H++2e-===H2↑
C.图B燃料电池工作时的负极反应物为O2
D.太阳能燃料电池的优点为无论天气如何,均能持续供应电能,并且实现对环境的“零排放”
[解析] 由工作原理示意图可以看出,“人造树叶”是光解水,将太阳能储存起来,A项错误;图A中塑料薄膜下部为H+得电子生成H2,B项错误;燃料电池的正极反应物为O2,C项错误;太阳能燃料电池是利用“人造树叶”光解产生的氢气与氧气形成燃料电池,故无论天气如何都可提供电能,D项正确。
[答案] D
角度2 电化学与化学实验有机融合
由于电化学知识中会涉及对电极材料、电解液中的离子等进行分析,因而电化学就容易与化学实验融合在一起进行考查,如电解液的制备、净化、电极反应产物的检验、电化学装置的设计等,提高了试题的综合度,有利于全面考查考生的基础知识及灵活解答问题的能力。在知识立意、注重能力的高考命题原则下,相信该类试题将继续受到推崇。
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应如下:
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应如下:
2CH3CHO+H2OCH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
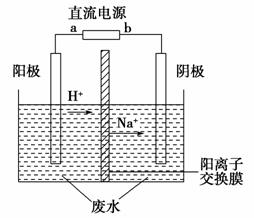
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入________(填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应式如下:
阳极:①4OH--4e-===O2↑+2H2O。
②________________________________________________。
阴极:①__________________________________________。
②CH3CHO+2e-+2H2O===CH3CH2OH+2OH-。
(3)电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。此时刻下列关于阳极区溶液中各微粒浓度关系的说法正确的是________(填序号)。
a.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
b.c(Na+)+c(H+)=c(SO)+c(CH3COO-)+c(OH-)
c.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)已知:乙醛、乙醇的沸点分别为20.8 ℃、78.4 ℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是________。
(6)在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg/L的废水,可得到乙醇________kg(计算结果保留小数点后1位)。
[解析] (1)甲烷燃料电池中,甲烷在负极发生氧化反应,电源的负极与电解池的阴极相连,甲烷在b极充入。(2)阳极发生氧化反应:CH3CHO-2e-+H2O===CH3COOH+2H+。阴极发生还原反应:2H++2e-===H2↑或2H2O+2e-===2OH-+H2↑。为了使得失电子守恒,阴、阳极的电极反应式得失电子数应匹配。(3)根据图示知,中间是阳离子交换膜,随着阴极区H+减少,为了维持电荷平衡,阳极区中钠离子向阴极区迁移,但是硫酸根离子没有参与迁移,Na2SO4的物质的量不变,新生成了NaOH,即Na+的物质的量增大。(4)根据物料守恒:n(Na2SO4)=n(CH3COOH),c(Na+)=2c(CH3COOH)+2c(CH3COO-),a正确;根据电荷守恒:c(Na+)+c(H+)=2c(SO)+c(CH3COO-)+c(OH-),b错误;醋酸呈酸性,醋酸电离出的H+对水电离出的OH-有抑制作用,故c(CH3COO-)>c(OH-),c正确。(5)乙醛和乙醇的沸点不同且互溶,可以用蒸馏法分离。(6)m(CH3CHO)=1 000 L×3 g/L=3 000 g=3 kg。根据化学方程式计算:CH3CHO~CH3CH2OH,m(CH3CH2OH)=60%×3 kg÷44 g/mol×46 g/mol≈1.9 kg。
[答案] (1)CH4
(2)CH3CHO-2e-+H2O===CH3COOH+2H+ 4H++4e-===2H2↑(写成“2H++2e-===H2↑”也可)或4H2O+4e-===2H2↑+4OH-
(3)不变 (4)ac (5)蒸馏 (6)1.9
角度3 在元素推断等知识中渗透电化学内容
物质推断、氧化还原反应、化学反应速率与化学平衡等知识是高考考查的重点内容,为了拓展知识考查的宽度,体现学科知识的密切相关性,故常在该类问题中设计一些简单的电化学知识,以提高试题的综合性,但难度不大。
 A、B、D、X、Y是由短周期元素组成的化合物,其中X是常见的强酸、Y是常见的强碱,它们之间的相互转化关系如图所示(部分生成物和水略去)。
A、B、D、X、Y是由短周期元素组成的化合物,其中X是常见的强酸、Y是常见的强碱,它们之间的相互转化关系如图所示(部分生成物和水略去)。
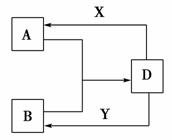
请回答下列问题:
(1)若A、B均为气体,在水溶液中反应生成D,其中A具有漂白性,则A的化学式为________,B发生催化氧化的化学反应方程式为_____________。
(2)若A、B、D含有相同的金属元素,工业用电解熔融氧化物的方法制取该金属单质。则此金属元素在周期表中的位置为____________。现将X滴入B的溶液中至过量,观察到的现象是__________________。
(3)若A为非极性分子,灼烧B、D、Y时火焰均为黄色。写出D+Y―→B的离子方程式:__________________。
写出D溶液中的电荷守恒表达式:____________。
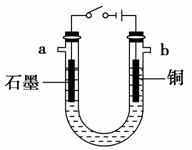
(4)现用如图所示的装置电解某浓度Y的水溶液,则下列叙述中不正确的是________(填序号)。
①电解过程中,阴极区溶液的pH增大
②a口产生的是氢气,b口产生的是氧气
③当电路中转移0.02 mol e-时,阳极的质量减小0.64 g
④电解的总反应式为Cu+2H2OCu(OH)2↓+H2↑
[解析] (1)由D可分别与强酸与强碱反应生成气体,则D必为弱酸的铵盐,由A具有漂白性可知A为SO2,B为NH3,D为(NH4)2SO3或NH4HSO3。(2)由工业用电解熔融氧化物的方法制取A、B、D中均含有的金属元素形成的单质,再结合框图中的转化关系可推出D为Al(OH)3,A为铝盐,B为偏铝酸盐,A、B反应得到Al(OH)3。(3)由B、D、Y的焰色反应均为黄色,可知三者均为钠的化合物,D与强酸反应生成非极性分子,则该非极性分子为CO2,D为Na2CO3或NaHCO3,再由D可与强碱反应生成B,则D必为NaHCO3,而B为Na2CO3。(4)Y为强碱,铜作阳极,则阳极发生反应Cu-2e-+2OH-===Cu(OH)2↓,没有气体生成;阴极发生反应2H++2e-===H2↑(或2H2O+2e-===H2↑+2OH-),电解的总反应式为Cu+2H2OCu(OH)2↓+H2↑,故①④叙述正确、②叙述不正确;根据电子守恒知③叙述正确。
[答案] (1)SO2 4NH3+5O2催化剂△4NO+6H2O
(2)第3周期ⅢA族 先有沉淀生成,然后沉淀逐渐消失
(3)HCO+OH-===CO+H2O c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)
(4)②
角度4 原电池与化学平衡移动相碰撞
将自发进行的氧化还原反应设计成原电池,根据阴、阳离子向电池的负极、正极移动来考查化学平衡移动原理和原电池原理,同时考查考生思维的灵活性以及运用知识的能力。
 已知可逆反应AsO+2I-+2H+
已知可逆反应AsO+2I-+2H+ AsO+I2+H2O,根据如图所示的装置进行下列操作:
AsO+I2+H2O,根据如图所示的装置进行下列操作:
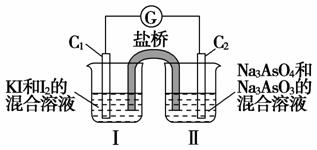
①向Ⅰ烧杯中逐滴加入浓盐酸,发现电流计指针偏转。
②若改向Ⅱ烧杯中滴加40%的NaOH溶液,发现电流计指针与①中的偏转方向相反。
下列有关说法不正确的是( )
A.①操作过程中C1棒上发生的反应为2I--2e-===I2
B.②操作过程中盐桥中的阳离子移向Ⅰ烧杯
C.若将电流计换成用惰性电极电解饱和食盐水的装置,在①操作过程中与C2棒连接的电极上有Cl2产生
D.若将电流计换成精炼铜装置,在②操作过程中与C1棒连接的为纯铜电极
[解析] ①操作过程中可逆反应正向进行,C1棒上发生的反应为2I--2e-===I2,C1棒为原电池的负极,C2棒为正极;利用惰性电极电解饱和食盐水的装置中与C2棒连接的电极为电解池的阳极,阳极的电极反应式为2Cl--2e-===Cl2↑,故A、C正确。②操作过程中可逆反应逆向进行,C1棒上发生的反应为I2+2e-===2I-,C1棒为原电池的正极,C2棒为负极,盐桥中的阳离子向正极区移动,即移向Ⅰ烧杯;在精炼铜装置中纯铜作阴极,应接C2棒,故B正确、D错误。
[答案] D
角度5 原电池与电解池的统一体——二次电池
二次电池的放电过程是原电池,充电过程是电解池。将电解池和原电池结合在一起考查化学反应中的能量变化、氧化还原反应、化学实验和化学计算等知识,此类题型是高考中有关电化学部分的重要题型。该类试题通常考查几个方面的内容,如电极的判断、电极反应式的书写、实验现象的描述、溶液中离子的移动方向、pH的变化、电解质溶液的复原以及运用电子守恒处理相关数据等。注重考查考生的知识迁移能力、灵活运用能力以及运用化学用语的能力。
 安徽省合肥市大力发展清洁能源产业,以太阳能为代表的新能源产业规模占全省的一半以上。试回答下列问题:
安徽省合肥市大力发展清洁能源产业,以太阳能为代表的新能源产业规模占全省的一半以上。试回答下列问题:
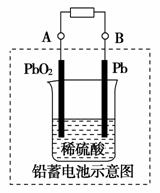
(1)现在电瓶车所用的电池一般为铅蓄电池,铅蓄电池示意图如图所示,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO 2PbSO4+2H2O。则该电池放电时,溶液的pH会________(填“增大”或“减小”),写出负极反应式:___________________________________。
2PbSO4+2H2O。则该电池放电时,溶液的pH会________(填“增大”或“减小”),写出负极反应式:___________________________________。
充电时,铅蓄电池的负极应与充电器电源的________(填“正”或“负”)极相连。
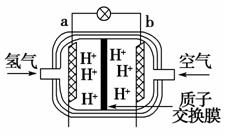
(2)为体现节能减排的理念,我国研制出了新型燃料电池汽车,该车装有“绿色心脏”——质子交换膜燃料电池。如图是某种质子交换膜燃料电池原理示意图。该电池的正极是________(填“a”或“b”,下同)极,工作过程中,质子(H+)透过质子交换膜移向________极,写出该电池的负极反应式:____________________________。
(3)最近,合肥市开工建设大型太阳能电池板材料生产基地,这种材料主要是高纯度的硅。下面关于硅的叙述中,正确的是________(填序号)。
A.硅的非金属性比碳的弱,只有在高温下才能跟氢气发生化合反应
B.SiO2与碳酸钠固体在高温条件下能发生反应,说明硅酸的酸性强于碳酸的酸性
C.SiO2是酸性氧化物,它不溶于任何酸
D.虽然硅的化学性质不活泼,但在自然界中却以化合态存在
E.硅是构成岩石的主要元素,硅元素在地壳中的含量在所有的元素中居第一位
[解析] (1)铅蓄电池放电时,负极为Pb,失去电子发生氧化反应Pb-2e-+SO===PbSO4,正极为PbO2,得到电子发生还原反应;铅蓄电池在充电时,是电解池装置,与充电器电源的负极相连的叫做阴极,即放电时的负极。(2)质子交换膜燃料电池负极发生的反应为H2-2e-===2H+,正极反应式为O2+4H++4e-===2H2O。(3)B中,不能说明硅酸的酸性强于碳酸的酸性;C中,SiO2是酸性氧化物,但它可溶于氢氟酸中;E中,硅是构成岩石的主要元素,硅元素在地壳中的含量在所有的元素中居第二位。
[答案] (1)增大 Pb-2e-+SO===PbSO4 负
(2)b b H2-2e-===2H+ (3)AD

(1)书写二次电池电极反应式的方法为将放电时负极反应式反写,即可得到充电时的阴极反应式;将放电时正极反应式反写,即可得到充电时的阳极反应式。
(2)二次电池充电时电池负极与电源的负极相连,电池正极与电源的正极相连。
角度6 电解池与水溶液中的离子平衡相碰撞
将电化学与水溶液中的离子平衡相结合的试题考查考生对知识灵活运用的能力,考查的内容主要为《选修4》中的内容,在高考中的重现率为100%。因此同学们要注意知识的横向联系,找到每个知识模块的连接点,培养综合运用知识的能力。
 A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液可组成原电池,A作负极;F常温下是气体,各物质之间有以下的转化关系(部分产物及条件已略去):
A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液可组成原电池,A作负极;F常温下是气体,各物质之间有以下的转化关系(部分产物及条件已略去):
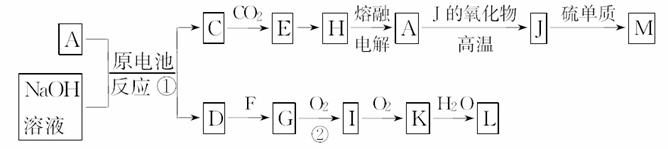
请回答以下问题:
(1)写出反应①的负极反应式:__________________________________________。
(2)写出②的化学反应方程式:____________________________________________________。
(3)M可用于实验室制取某气体,写出该反应的化学方程式:_______________________________。
(4)含A元素的某复盐X常作净水剂,X进行焰色反应时,透过蓝色钴玻璃片观察火焰呈紫色,则X晶体的俗名为_____,向含1mol该复盐的溶液中加入Ba(OH)2溶液,至阴离子恰好完全沉淀,则A元素的存在形式为(写出化学式即可)____。
(5)常温时pH=12的C溶液中,溶质的阳离子与阴离子的浓度之差为____________;相同条件下,等浓度的C溶液与CH3COONa溶液中,C电离出的阴离子与CH3COO-浓度的大小关系:前者________(填“>”、“<”或“=”)后者。
[解析] 由A、J是日常生活中常见的两种金属,则A、J分别为铁、铝中的一种,再由这两种金属和NaOH溶液可组成原电池及A作负极可知A为铝,由A→J的反应条件可知J为铁,A→J为铝热反应,铁与硫在加热条件下反应生成FeS。Al—Fe—NaOH溶液组成原电池时,负极发生反应Al+4OH--3e-===AlO+2H2O,故D为H2,C为NaAlO2溶液。由G→I→K为连续氧化过程,结合F为气体,则G、I、K、L分别为NH3、NO、NO2、HNO3。(4)该复盐为明矾,其化学式为KAl(SO4)2·12H2O,含1 mol明矾的水溶液中含有1 mol Al3+和2 mol SO,要完全沉淀SO时需要加入Ba(OH)2 2 mol,此时提供4 mol OH-,恰好与Al3+发生反应:Al3++4OH-===AlO+2H2O,故Al的存在形式为KAlO2。(5)pH=12的NaAlO2溶液中,根据溶液呈电中性可得c(H+)+c(Na+)=c(AlO)+c(OH-),整理可得c(Na+)-c(AlO)=c(OH-)-c(H+)=(10-2-10-12)mol/L。等浓度的NaAlO2溶液与CH3COONa溶液中,前者阴离子的水解程度大,故其浓度小。
[答案] (1)Al+4OH--3e-===AlO+2H2O
(2)4NH3+5O2催化剂△4NO+6H2O
(3)FeS+2HCl===FeCl2+H2S↑
(4)明矾 KAlO2 (5)(10-2-10-12)mol/L <

2.可充电电池电极反应式的书写方法
书写可充电电池的电极反应式,一般都是先书写放电时的电极反应式。书写放电时的电极反应式一般有三步:第一步,先标出原电池总反应式中电子转移的方向和数目,确定参与负极和正极反应的物质;第二步,写出一个比较容易的电极反应式(书写时一定要注意电极产物是否能与电解质溶液共存);第三步,在电子守恒的基础上,用总反应式减去写出的电极反应式即得另一个电极反应式。
充电时的电极反应过程与放电时的电极反应过程相反,充电时的阳极反应为放电时正极反应的逆过程,充电时的阴极反应为放电时负极反应的逆过程。
1.可充电电池放电时电极极性的判断及充电时与电源的连接
(2)可充电电池充电时,原电池的负极与外电源的负极相连,原电池的正极与外电源的正极相连。
4.物质的鉴别有多种方法。下列能达到鉴别目的的是( )
①用水鉴别苯、乙醇、溴苯 ②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 ③点燃鉴别甲烷和乙炔
④用品红溶液鉴别二氧化碳、二氧化硫、一氧化碳 ⑤用石蕊试液鉴别酒精、醋酸、醋酸钠
A.①②④ B.①③⑤
C.②③④ D.①②③
[解析] ①苯的密度比水小且与水不相溶。乙醇与水互溶。溴苯的密度比水的大且与水不相溶,故可用水鉴别苯、乙醇、溴苯。②中Ca(OH)2与NaHCO3溶液相互滴加现象都是产生白色沉淀,故无法用相互滴加法鉴别Ca(OH)2和NaHCO3溶液。③中甲烷燃烧无黑烟,乙炔燃烧火焰明亮且伴有大量黑烟,故可用点燃法鉴别甲烷和乙炔。④中二氧化硫可使品红溶液褪色、CO2和CO不能,故无法用品红溶液鉴别CO2、SO2、CO。⑤中酒精溶液呈中性、醋酸溶液显酸性、醋酸钠溶液显碱性,故可用石蕊试液鉴别酒精、醋酸、醋酸钠,选B。
[答案] B
3.下列物质鉴别所用试剂不正确的是( )
A.乙醇与乙酸用CaCO3固体
B.乙烷和乙烯用NaOH溶液
C.苯、CCl4和甲酸用水
D.乙烯与乙烷用溴水
[解析] 乙酸酸性比碳酸强,能够与CaCO3反应,乙醇不能,A项正确;乙烷和乙烯均不能与NaOH溶液反应,B项不正确;甲酸能够与水互溶,苯和CCl4均不溶于水,苯的密度比水小,CCl4的密度比水大,C项正确;乙烯能够与溴水发生加成反应,乙烷不能与溴水反应,D项正确。
[答案] B
2.将乙醇和乙酸分离的正确方法是( )
A.加热蒸馏
B.先加入烧碱溶液,蒸出乙醇;再加入硫酸,然后蒸出乙酸
C.加入碳酸钠后,通过萃取的方法分离
D.利用分液的方法直接进行分离
[解析] 乙醇和乙酸互溶,不能直接分液;直接加热蒸馏时,两者都易挥发,得到的物质仍不纯;先加入烧碱使乙酸生成不挥发的醋酸钠,可将乙醇蒸出,再加入硫酸生成醋酸,加热蒸馏可得到乙酸。
[答案] B
1.只用一种试剂就能将苯、己烯、四氯化碳和碘化钾溶液区分开,该试剂可以是( )
A.酸性高锰酸钾溶液 B.溴化钠溶液
C.溴水 D.硝酸银溶液
[解析] 酸性高锰酸钾溶液遇己烯、KI溶液均褪色;溴化钠只能区别有机物中的一种。苯萃取溴,油层在上;溴水遇己烯褪色,遇CCl4油层在下,遇KI溶液变色。AgNO3溶液可鉴别出KI溶液及一种有机物。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com