
2.利用平衡常数确定粒子浓度比值的变化
 (2011·山东高考)室温下向10 mL
pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
(2011·山东高考)室温下向10 mL
pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
[解析] 由于醋酸是弱电解质,在溶液中存在CH3COOH CH3COO-+H+平衡,加水稀释后,该平衡右移,醋酸的电离程度增大,导电粒子(CH3COO-和H+)数目增多,A错误;由于溶液稀释,c(H+)先变大后变小,C错误;B项中分子、分母分别乘以c(H+)后,分式为c(CH3COO-)·c(H+)/[c(CH3COOH)·c(H+)c(OH-)]=Ka(CH3COOH)/Kw,由于温度不变,醋酸的平衡常数、水的离子积不变,所以分式的值不变,B正确;当加入等体积,pH=11氢氧化钠溶液,形成醋酸钠和醋酸的混合溶液,pH<7,D错误。
CH3COO-+H+平衡,加水稀释后,该平衡右移,醋酸的电离程度增大,导电粒子(CH3COO-和H+)数目增多,A错误;由于溶液稀释,c(H+)先变大后变小,C错误;B项中分子、分母分别乘以c(H+)后,分式为c(CH3COO-)·c(H+)/[c(CH3COOH)·c(H+)c(OH-)]=Ka(CH3COOH)/Kw,由于温度不变,醋酸的平衡常数、水的离子积不变,所以分式的值不变,B正确;当加入等体积,pH=11氢氧化钠溶液,形成醋酸钠和醋酸的混合溶液,pH<7,D错误。
[答案] B
六、平衡常数之间联系的应用
归纳:Kw、Ka、Kb、Ksp、Kh之间的关系:
(1)一元弱酸一元强碱盐:Kh=Kw/Ka;
(2)一元强酸一元弱碱盐:Kh=Kw/Kb;
(3)一元弱酸一元弱碱盐,如醋酸铵:Kh=Kw/(Ka×Kb);
(4)多元弱碱一元强酸盐,如氯化铁:
Fe3+(aq)+3H2O(l)  Fe(OH)3(s)+3H+(aq)
Fe(OH)3(s)+3H+(aq)
水是纯液体,Fe(OH)3是固体物质不列入平衡常数。
Kh=c3(H+)/c(Fe3+)。
将(Kw)3=c3(H+)×c3(OH-)与Ksp=c(Fe3+)×c3(OH-)两式相消去c3(OH-)
所以,Kh=(Kw)3/Ksp
特别注意:以上各种平衡常数都只与温度有关。
1.已知某反应的平衡常数求另一反应的平衡常数
 (2011·福建高考节选)已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+
(2011·福建高考节选)已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=________。
Fe3++3H2O的平衡常数K=________。
[解析] Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.79×10-39,25 ℃时,c(H+)×c(OH-)=Kw=1×10-14;反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=c(Fe3+)÷c3(H+)===2.79×103。
Fe3++3H2O的平衡常数K=c(Fe3+)÷c3(H+)===2.79×103。
[答案] 2.79×103
五、盐类水解平衡常数
如醋酸钠:
CH3COO-(aq)+H2O(l)  CH3COOH(aq)+OH-(aq)
CH3COOH(aq)+OH-(aq)
Kh==Kw/Ka
①Kh是一定温度下的常数,温度不变,Kh不变,升温Kh增大。
②相同条件下,Kh增大,表示该盐越易水解,所对应的酸或碱相对越弱。
考点:以弱酸盐或弱碱盐的水解常数为载体,考查盐溶液的性质,或稀释时的变化情况,还可能考查对应弱酸的相对强弱。
四、溶度积常数
对于沉淀溶解平衡MmAn(s)  mMn+(aq)+nAm-(aq) Ksp=cm(Mn+)·cn(Am-)
mMn+(aq)+nAm-(aq) Ksp=cm(Mn+)·cn(Am-)
溶度积(Ksp)反映了物质在水中的溶解能力。溶度积常数只与难溶性电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。
考点:溶度积(Ksp)的计算与除去废水中的离子。
以溶度积(Ksp)为桥梁计算难溶物之间是否可以转化、哪种离子优先沉淀或选用什么样的试剂来沉降废水中的离子等。
 (2014·潍坊模拟)已知298 K时下列物质的溶度积(单位略)。
(2014·潍坊模拟)已知298 K时下列物质的溶度积(单位略)。
|
|
CH3COOAg |
AgCl |
Ag2CrO4 |
Ag2S |
|
Ksp |
2.3×10-3 |
1.77×10-10 |
1.12×10-12 |
6.7×10-15 |
下列说法正确的是( )
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的CrO和Cl-的溶液中慢慢滴入AgNO3溶液时,CrO先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-===CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度:
c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
[解析] Ksp(CH3COOAg)>Ksp(AgCl),向CH3COOAg悬浊液中加入盐酸时CH3COOAg转化为AgCl,离子方程式为CH3COOAg+H++Cl-===CH3COOH+AgCl,C正确。
[答案] C
三、水的离子积常数
在一定温度下,c(H+)·c(OH-)是个常数,通常用Kw表示,称为水的离子积常数,简称离子积常数。其表达式为Kw=c(H+)·c(OH-),25 ℃时该常数为1×10-14。
①Kw是一定温度的常数,温度不变,水的离子积常数不变。
②在任何情况下,无论是把酸还是把碱加到水中,纯水电离出的c(H+)=c(OH-)。
考点:考查Kw与温度的变化、溶液pH之间的联系。利用Kw与温度的变化来考查溶液pH的计算,是高考的考查方向。
 T ℃下的溶液中,c(H+)=10-x
mol·L-1,c(OH-)=10-y
mol·L-1,x与y的关系如图所示。下列说法不正确的是( )
T ℃下的溶液中,c(H+)=10-x
mol·L-1,c(OH-)=10-y
mol·L-1,x与y的关系如图所示。下列说法不正确的是( )
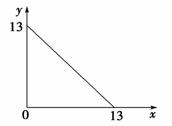
A.T ℃时,水的离子积Kw为1×10-13
B.T>25
C.T ℃时,pH=7的溶液显碱性
D.T ℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7
[解析] 从图不难看出,A正确;T ℃时Kw大于1×10-14,则T ℃一定高于常温,B正确;T ℃时,pH=6.5的溶液呈中性,显然pH=7的溶液显碱性,C正确;pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,二者恰好完全中和,但注意该温度下,pH=7的溶液不是中性溶液,D错误。
[答案] D
2.特点:(1)电离常数只与温度有关,升温,Ka增大。
(2)相同条件下,Ka越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
(3)多元弱酸的各级电离常数的大小关系是Ka1≫Ka2≫Ka3,故多元弱酸的酸性取决于其第一步电离常数。
考点:以弱酸或弱碱的电离常数为载体,考查多种酸或碱性质的比较,或稀释时的变化情况,还有可能考查弱酸或弱碱对应的同类型盐的水解能力的强弱。
 已知三个数据:7.2×10-4、4.6×10-4、4.9×10-10,分别是三种酸的电离常数,若已知可以发生反应NaCN+HNO2===HCN+NaNO2、NaCN+HF===HCN+NaF、NaNO2+HF===HNO2+NaF。
已知三个数据:7.2×10-4、4.6×10-4、4.9×10-10,分别是三种酸的电离常数,若已知可以发生反应NaCN+HNO2===HCN+NaNO2、NaCN+HF===HCN+NaF、NaNO2+HF===HNO2+NaF。
由此可判断下列叙述不正确的是( )
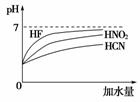
A.Ka(HF)=7.2×10-4
B.Ka(HNO2)=4.9×10-10
C.同浓度的钠盐溶液的碱性是NaF<NaNO2<NaCN
D.根据两个反应即可得出一元弱酸的稀释情况如图所示
[解析] 相同温度下弱电解质的电离常数是比较弱电解质相对强弱的依据之一。根据第一、第三个反应可知三种一元弱酸的强弱顺序为HF>HNO2>HCN。由此可判断Ka(HF)>Ka(HNO2)>Ka(HCN),其对应的数据依次为Ka(HF)=7.2×10-4、Ka(HNO2)=4.6×10-4、Ka(HCN)=4.9×10-10。同浓度的钠盐溶液的碱性是对应的酸越强,碱性越弱,即NaF<NaNO2<NaCN。酸性越强,稀释时变化曲线的斜率越大。
[答案] B
二、弱电解质的电离常数
1.表达式:(1)对于一元弱酸HA:HA H++A-,电离常数Ka=。
H++A-,电离常数Ka=。
(2)对于一元弱碱BOH:BOH B++OH-,电离常数Ka=。
B++OH-,电离常数Ka=。
3.判断反应进行的方向
对于可逆反应mA(g)+nB(g)  pC(g)+qD(g),在一定温度下的任意时刻,生成物浓度系数幂次方乘积除以反应物浓度系数幂次方乘积所得的比,即Qc=,称为该反应的浓度商。若同一温度下该可逆反应达到平衡时的平衡常数为K。
pC(g)+qD(g),在一定温度下的任意时刻,生成物浓度系数幂次方乘积除以反应物浓度系数幂次方乘积所得的比,即Qc=,称为该反应的浓度商。若同一温度下该可逆反应达到平衡时的平衡常数为K。
则:①Qc<K,反应向正反应方向进行;②Qc=K,反应处于平衡状态;③Qc>K,反应向逆反应方向进行。
 在某温度下,在一容积可变的容器中,反应2A(g)+B(g)
在某温度下,在一容积可变的容器中,反应2A(g)+B(g)  2C(g)达到平衡时,A、B和C的物质的量分别为4
mol、2 mol和4
mol。保持温度和压强不变,对平衡混合物中三者的物质的量进行如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4
mol、2 mol和4
mol。保持温度和压强不变,对平衡混合物中三者的物质的量进行如下调整,可使平衡右移的是( )
A.均减半 B.均加倍
C.均增加1 mol D.均减少1 mol
[解析] 温度和压强不变,根据阿伏加德罗定律,得到气体的体积与气体的物质的量成正比。假设1 mol气体的体积为V L,平衡时10 mol混合气体的体积为10V L,则K===5V。
A项和B项中各物质的量均减半或加倍,根据阿伏加德罗定律,总气体的体积同比变化,各物质的浓度不变,平衡不移动。C项中各物质的物质的量均增加1 mol,气体的总的物质的量是13 mol,体积是13V L:Qc=
=≈4.33V<K,平衡向右移动。D项中各物质的量均减少1 mol,气体的总的物质的量是7 mol,体积是7V L:Qc==
=7V>K,平衡向左移动。
[答案] C
2.判断平衡状态时的含量
根据在某种情况下可逆反应达到平衡时确定各组分的浓度,从而计算出K,或者根据K计算可逆反应达到平衡时某种组分的浓度(可以换算成其他物理量)。
 将1
mol H2O(g)和1 mol
CO(g)充入反应容器中,发生反应CO(g)+H2O(g)
将1
mol H2O(g)和1 mol
CO(g)充入反应容器中,发生反应CO(g)+H2O(g)  CO2(g)+H2(g),达到平衡时,有2/3的CO转化为CO2。在相同条件下,将1
mol CO(g)和2 mol H2O(g)充入同一反应容器中,当反应达到平衡后,混合气体中CO2的体积分数可能为( )
CO2(g)+H2(g),达到平衡时,有2/3的CO转化为CO2。在相同条件下,将1
mol CO(g)和2 mol H2O(g)充入同一反应容器中,当反应达到平衡后,混合气体中CO2的体积分数可能为( )
A.22.2% B.28.2%
C.33.3% D.37.8%
[解析] 首先计算出反应的化学平衡常数:
CO(g)+H2O(g)CO2(g)+H2(g)
起始/mol: 1 1 0 0
变化/mol: 2/3 2/3 2/3 2/3
平衡/mol: 1/3 1/3 2/3 2/3
K=c(CO2)·c(H2)/[c(CO)·c(H2O)]=(2/3)2/(1/3)2=4
在相同条件下,充入1 mol CO(g)和2 mol H2O(g),则有:
CO(g)+H2O(g)CO2(g)+H2(g)
起始/mol: 1 2 0 0
变化/mol: x x x x
平衡/mol: 1-x 2-x x x
K=c(CO2)·c(H2)/[c(CO)·c(H2O)]=x2/[(1-x)·(2-x)]=4,解得x≈0.846,即φ(CO2)=×100%=28.2%。
[答案] B

本题也可以用极值法进行求解,第一次充入1 mol H2O(g)和1 mol CO(g),达到平衡时CO的转化率为2/3。第二次充入物质的量相当于第一次充入后再次充入1 mol H2O(g),平衡正向移动,所以CO的转化率大于2/3,CO2的体积分数一定大于22.2%。CO一定不可能完全转化为CO2,所以其体积分数一定小于1/3,即33.3%,故只有选项B满足条件。
一、化学平衡常数
在一定温度下,可逆反应达到平衡状态时,生成物浓度的幂次方乘积与反应物浓度的幂次方乘积之比叫化学平衡常数,用K表示。
1.考查化学平衡常数表达式的书写
在一定温度下,写出某可逆反应达到化学平衡状态时的化学平衡常数表达式。
(1)固体或纯液体的浓度是常数。如果有固体或纯液体参加反应或生成时,化学平衡常数表达式中不能出现固体或纯液体;水溶液中进行的反应,如有水参加反应,由于水的浓度是常数,不出现在表达式中;非水溶液中进行的反应,若有水参加反应或生成,则应出现在表达式中。例如:
①CaCO3(s)  CaO(s)+CO2(g) K=c(CO2)
CaO(s)+CO2(g) K=c(CO2)
②3Fe(s)+4H2O(g)  Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
K=
③Cr2O(aq)+H2O(l)  2CrO(aq)+2H+(aq)
2CrO(aq)+2H+(aq)
K=
④CH3COOH(l)+CH3CH2OH(l)  CH3COOCH2CH3(l)+H2O(l)
CH3COOCH2CH3(l)+H2O(l)
K=
(2)化学平衡常数表达式与化学计量数一一对应,方程式中化学计量数不同,表达式就不同;可逆反应中,正反应的化学平衡常数与逆反应的化学平衡常数互为倒数。例如:同一温度下,下列反应的平衡常数分别为K1、K2、K3。
①I2(g)+H2(g)  2HI(g);②2HI(g)
2HI(g);②2HI(g)  I2(g)+H2(g);③HI(g)
I2(g)+H2(g);③HI(g)  I2(g)+H2(g)。
I2(g)+H2(g)。
则:K1=、K2=、K3=,可得K1·K2=1,K2=K。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com