
14.将固体MnC2O4?2H2O放在坩锅里加热,固体质量随温度变化的数据如下表:
温度/℃
25
50
75
100
214
280
固体质量/g
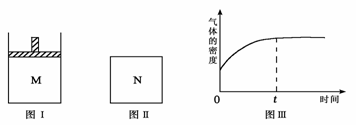 平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是
平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是
A.x =4
B.若N中气体的密度如图Ⅲ所示,则A、B有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
13.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:
12.在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生: ① IO3-+ 5I―+ 6H+ → 3I2 + 3H2O ② I2 + 2HSO3-+ H2O → 2I- + 2SO42-+ 4H+
当反应进行到15min时,溶液突然变为蓝色,随之又很快消失。这一反应被称做时钟反应,有人用它来解释生物钟现象。下列有关说法不正确的是
A.在整个反应过程中,起催化作用的物质是KI
B.上述两个反应中,反应速率较快的是②
C.时钟反应的快慢由反应②决定
D.“溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关
11.下列离子方程式书写正确的是
A.NaHSO4溶液中滴入Ba(OH)2溶液至中性: H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.将少量的硝酸银溶液滴入氨水中 Ag+ + NH3?H2O = AgOH↓ + NH4+
C.Ca(HCO3)2溶液中加入过量KOH溶液:Ca2+ + HCO3-+OH-==CaCO3↓+ H2O
D.硫酸亚铁酸性溶液中加入过氧化氢:4Fe2+ + 2H2O2 + 4H+ = 4Fe3+ + 4H2O
D.每生成7.5gAs,还原剂失去0.3mol电子
10.在浓盐酸中,H3AsO3与 SnCl2反应的离子方程式为:
3SnCl2+ 12Cl-+ 2H3AsO3+6H+=2As +3 SnCl62-+
A.在反应中Sn元素被氧化, As元素被还原
B.氧化剂是SnCl2,氧化产物为SnCl62-
C.生成物M为OH-
9.下列关于某些物质的检验方法正确的是
A.利用Ba(OH)2鉴别Na2CO3溶液和NaHCO3溶液
B.用焰色反应鉴别NaCl、KCl和Na2SO4三种物质
C.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
D.通过向瓶中加入适量水观察溶液颜色变化证明一瓶气体是溴蒸气还是二氧化氮
B.常温下,向100mL 3mol/L的硝酸中加入
C.在适当温度和催化剂作用下,用2molSO2和1molO2合成SO3
D.将含有少量H2O(g)的H2通入盛有足量Na2O2容器中并不断用电火花点燃
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com