
 (5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值在于( )
(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值在于( )
A.将1 mol Fe3O4氧化成高铁酸盐需10/3 mol电子,可提高电流效率
B.以低价态铁的氧化物为电极,可以实现变废(铁锈)为宝(高铁酸盐)
C.自然界几乎没有铁单质,而有大量磁铁矿,该方法的原料来源广泛
D.磁铁矿作为多孔电极不会出现钝化现象
六、(本题包括1小题,共10分)
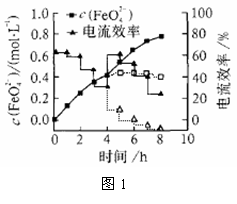 (3)FeO42-易与水反应生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图1中4 h后)过滤掉氢氧化铁,合成过程中FeO42-浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1 h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是( )
(3)FeO42-易与水反应生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图1中4 h后)过滤掉氢氧化铁,合成过程中FeO42-浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1 h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是( )
A.过滤掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
B.过滤掉氢氧化铁对电流效率影响不大
C.实验表明氢氧化铁的存在影响高铁酸盐浓度的增加
D.实验表明不过滤掉氢氧化铁,6 h后电流效率几乎为0
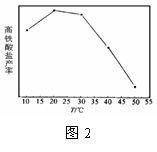
(4)碱性条件下,高铁酸盐的稳定性与温度有关(如图2)。随温度升高,高铁酸盐产率先增大后减小的原因是 。
19.(12分)高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电化学法。
(1)电化学法制备高铁酸钠采用铁片作阳极,NaOH溶液作为电解质溶液,其电流效率可达到40%。写出阳极的电极反应式: 。
(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是 。研究亦发现,铁电极在某一电压范围内会生成Fe2O3膜而“钝化”,钝化的原因可能是 。
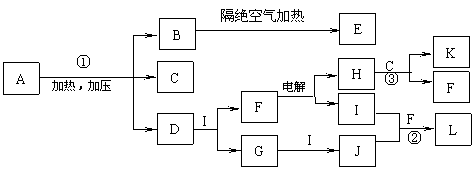 18.(10分)已知下图每一方框中的字母代表一种反应物或生成物(图中部分生成物没有列出)。化合物A是一种常用的肥料,其化学式可表示为XY4ZM2,组成A的四种元素都是短周期元素、其原子序数之和为22,X、M、Z分别位于相邻的主族,原子序数依次增大。C、D、G、I、J、K为气体,其中C、K的温室效应均显著,K是含碳量最高的有机物,D能使湿润的红色石蕊试纸变蓝。B为一种白色固体,其化学式可表示为X3Y
18.(10分)已知下图每一方框中的字母代表一种反应物或生成物(图中部分生成物没有列出)。化合物A是一种常用的肥料,其化学式可表示为XY4ZM2,组成A的四种元素都是短周期元素、其原子序数之和为22,X、M、Z分别位于相邻的主族,原子序数依次增大。C、D、G、I、J、K为气体,其中C、K的温室效应均显著,K是含碳量最高的有机物,D能使湿润的红色石蕊试纸变蓝。B为一种白色固体,其化学式可表示为X3Y
(1)反应①、②、③的化学方程式分别为 、 、 。
(2)B中M的质量分数为 。
(3)化合物E是一种新型无机材料,它的一种结构(β- X
五、(本题包括1小题,12分)
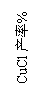
 (2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5。这样做的目的是 。
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5。这样做的目的是 。
(3)右图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在
时,CuCl产率能达到94%。随后随温度升高CuCl产率
会下降,其原因是 。
(4)若要提高CuCl的产率你认为还可采取的措施
有 。
 请回答以下问题:
请回答以下问题:
(1)写出反应①制备氯化亚铜的离子反应方程式: 。
17.(12分)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂, 还可用于颜料, 防腐等工业。该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程图。
16.(6分)根据下表中序号1提供的探究样例,设计实验探究方案(要求方案尽可能简单)。
序号
探究问题的两种不同猜想
设计实验探究方案
(1)
向品红溶液中通入一种常见气体后,品红褪色。
甲:通入的是氯气。
乙:通入的是二氧化硫。
实验设计:将褪色后的溶液加热,若红色再现,则通入的是二氧化硫,乙正确;若不再变红,则通入的气体是氯气,甲正确。
(2)
在含有酚酞的氢氧化钠溶液中,滴加新制氯水,边滴边振荡,直到红色刚好褪去。
甲:氯水中的HCl、HClO中和NaOH所致。
乙:氯水中的HClO具有强氧化性使红色酚酞褪色。
实验设计:
。
(3)
加热稀氨水,溶液中的c(OH一)的变化。
甲:c(OH一)将增大。升高温度有利于电离平衡移动,使氨水中c(OH一)增大。
乙:c(OH一)将减小。受热时氨易逸出,使c(OH一)减小。
实验设计:
。
(4)
在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。
甲: NH4Cl水解产生的H+与Mg(OH)2电离出来的OH一发生中和反应而使Mg(OH)2溶解。
乙:NH4Cl电离出的NH4+与Mg(OH)2电离出的OH一结合成弱电解质NH3?H2O,使Mg(OH)2的溶解平衡向右移动,使Mg(OH)2溶解。
实验设计:
(提示:选择合适试剂加入到Mg(OH)2悬浊液中)
。
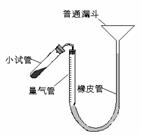 15.(12分)过氧化钙是重要的工业原料,
15.(12分)过氧化钙是重要的工业原料,
(1)上述制备工艺中,分离主产品的操作方法是______、烘干,分离出副
产品的操作方法是 。
(2)右图装置,检查系统是否漏气的方法是 。
(3)正确读取量气管内液面的初、终读数前都需进行的操作是___,加热小试管
时,随着过氧化钙分解,量气管内的液面逐渐下降,为防止试管和量气管内气体压强过大。可进行的操作是_________________________.
(4)已知:样品质量m g,量气管初读数a mL,终读数b mL,该实验条件下,Vm=c L?mol?1。计算样品中过氧化钙的含量表达式为 w%=_______________________。
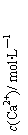
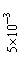
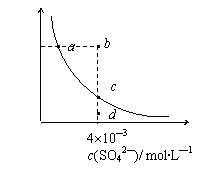 14.常温下,Ksp(CaSO4)=9´10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是
14.常温下,Ksp(CaSO4)=9´10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是
A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42―)对应于曲线上任
意一点
B.b点将有沉淀生成,平衡后溶液中c(SO42―)一定等于3´10-3 mol?L―1
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
第Ⅱ卷(非选择题,共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com