
10.下列离子浓度关系正确的是
A. 0.1 mol / L的NH4Cl溶液中c(NH4+)= c(Cl-)
B.同为0.1 mol / L的甲酸和氢氧化钠溶液等体积混合后, c(OH-)= c(H+)
C.向NH4Cl溶液中滴加氨水至pH=7 时,c(NH4+)< c(Cl-)
D.pH=3的H2SO4和pH=11的NaOH溶液等体积混合后,溶液中c(OH-)= c(H+)
9.将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:
X (气)+3 Y (气)  2 Z (气) + a Q (气)
2 Z (气) + a Q (气)
2 min达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol / L,下列叙述错误的是
A.a的值为2
B.平衡时X的浓度为0.2 mol / L
C.Y的转化率为60%
D.反应速率v(Y)=0.3 mol / (L·min)
8.四种元素在周期表中相对位置为 其中W的一种原子是3618W,则下列判断错误的是
A.原子半径X<Y<Z
B.气态氢化物稳定性X>Y>Z
C. 气态氢化物还原性X>Y>Z
D.最高价氧化物对应水化物的酸性X>Y>Z
7.用NA表示阿伏加德罗常数,下列说法错误的是
A. 乙醇的摩尔质量(g / mol)与NA个乙醇分子的质量(g)在数值上相等
B. 1mol Mg作为还原剂可提供的电子数为2NA
C. 常温常压下,28 g CO中所含碳原子数为0.5NA
D. 0.5 L、0.2 mol / L的Fe2(SO4)3溶液中含SO42-个数为0.3 NA
|
Z |
Y |
X |
W |
6.下列生活中的化学小实验不合理的是
A. 用米汤检验加碘盐中的碘酸钾(KIO3)
B. 用食用醋除去热水瓶中积存的水垢
C. 用纯碱(Na2CO3)溶液洗涤沾有油污的器具
D. 用灼烧并闻气味的方法区分化纤织物与纯毛织物
5.氯化铁溶液和氢氧化铁胶体具有的共同性质是
A.两种液体都是红褐色
B.分散质粒子都能通过半透膜
C.分散质粒子大小都在1 nm ~ 100 nm 之间
D.加热、蒸干、灼烧后,得到相同的固体
2007.5
(考试时间150分钟 满分300分)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分
第I卷(选择题,共120分)
本卷共20题,每小题6分,共120分,在下列各题的四个选项中,只有一个选项是符合题目要求的。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23
33.(8分)[化学--有机化学基础]
有机物A、B、C、D、E、F有如下转化关系:
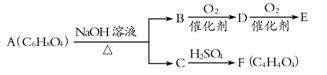
已知:①A可使溴水褪色,难溶于水 ②F无支链 ③E能发生银镜反应
请回答下列问题:
(1)E中所含官能团的名称是 ;
(2)F的结构简式为,与F具有相同官能团的同分异构体的结构简式为 ;
(3)由F制取A的化学方程式是 ;
(4)A不能发生的反应有 (选填序号)。
①加成反应 ②消去反应 ③加聚反应 ④氧化反应 ⑤酯化反应
32.(8分)[化学--物质结构与性质]
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相发生反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示。
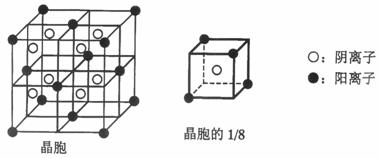
(1)D元素原子的价电子排布式是 ;
(2)A、B、C、D四种元素的原子半径由小到大的顺序为 (用元素符号表示);
(3)A和D的氢化物中,后者沸点较低,原因是 ;
(4)A和E的化合物晶体中,每个阳离子周围与它最近且距离相等的阳离子共有 个;
(5)已知A和E所形成化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的化合物晶体的密度为 (结果保留一位小数)。
31.(8分)[化学--化学与技术]
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
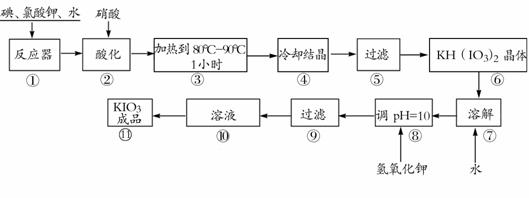
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有 ;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为: ;
(6)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com