
33.(8分)[化学--有机化学基础]
自2003年以来,中国、日本和越南相继爆发禽流感。随后禽流感又在全球蔓延,并造成多人死亡。世界卫生组织警告说,禽流感对人类的潜在威胁要远大于“非典”,可能导致全球经济大幅度的衰退。2005年瑞士罗氏制药公司介绍了抗禽流感药物“达菲”的生产工艺。合成“达菲”的重要中间体为莽草酸。
(1)莽草酸是一种有机物,其相对分子质量不超过200,是一种白色粉末,易溶于水,难溶于氯仿和苯。取一定量样品燃烧,产物只有CO2和H2O且有n(CO2):n(H2O)=7:5,消耗的O2和生成的CO2的物质的量相等,则莽草酸的分子式为___________________。
(2)以下是以莽草酸为原料合成有机物B和D的路线:
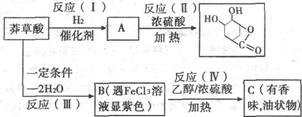
①上述反应中属于消去反应的是____________(填序号)。
②莽草酸的结构简式为__________。
③写出B可能的结构简式__________。
32.(8分)[化学--物质结构与性质]
下表由元素周期表的前三周期去掉副族上方空区域后组合而成,表中虚线处为ⅡA、ⅢA
族的连接处。请用相应的化学用语回答下列问题:
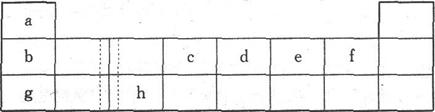
(1)h的单质能与g元素的最高价氧化物对应的水化合物的溶液反应,请写出该反应的离子方程式___________________________
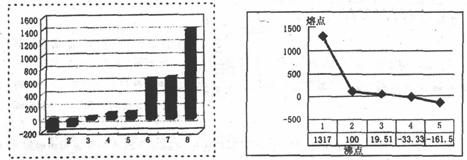
(2)上左图是第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“l”代
表Ar),则其中序列“2”原子的结构示意简图为_________,“8”原子的电子排布式为________。
(3)上右图是b、c、d、e.f的氢化物的沸点直角坐标图,序列"5"氢化物的化学式为_________,序列“1”的氢化物的电子式:_________。
(4)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该燃料电池的________极发生电极反应,电极反应式为________。
31.(8分)[化学--化学与技术]
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前,以下“技术”中,可用于“海水淡化”的是______(填序号)。
①蒸馏法 ②膜分离法(电渗析、反渗透) ③冷冻法 ④离子交换法
(2)海水晒盐利用的化学原理是________;分离食盐晶体后的母液中含有_________,经过分离、提纯后,可用于__________。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应的离子方程式为_________;电解所用的食盐水需要精制,为什么?____________;精制时所用试剂为:盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液。加入试剂时,Na2CO3溶液必须在加入_________之后加入。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
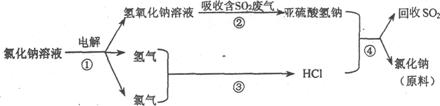
写出反应②的化学方程式:__________________________________。
30.(14分)某校化学兴趣小组的同学在进行研究性学习时,决定自己动手探究“NO2能否支持燃烧”的问题。
(1)甲组同学设计的方案是:向烧瓶中加入适量浓硝酸并加热,当烧瓶中有红棕色气体产生之后,将燃着的术条伸人烧瓶中,发现本条火焰熄灭。
①写出浓硝酸受热分解的化学方程式___________________________________。
⑦根据甲组同学设计的方案,能不能得出“NO2不能支持燃烧”的结论?______(填“能”或“不能”)。推断的理由是___________________________________________________。
(2)乙组同学通过查阅资料得知,某些不活泼金属的硝酸盐受热时也能产生NO2气体。
 如2Cu(NO3)2
如2Cu(NO3)2 2CuO+4N02↑+02↑,2AgN03
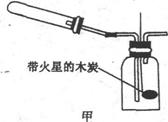
2CuO+4N02↑+02↑,2AgN03 2Ag+2N02↑+02↑.他们根据此原理设计如图甲所示的实验装置(加热夹持仪器未画出),并分别用Cu(NO3)2和AgNO3进行实验,实验中发现当红棕色气体进入集气瓶后,带火星的木炭均能复燃,乙组同学由此得出“NO2能支持燃烧”的结论。
2Ag+2N02↑+02↑.他们根据此原理设计如图甲所示的实验装置(加热夹持仪器未画出),并分别用Cu(NO3)2和AgNO3进行实验,实验中发现当红棕色气体进入集气瓶后,带火星的木炭均能复燃,乙组同学由此得出“NO2能支持燃烧”的结论。
①乙组同学使用该装置进行实验时,从环保和安全的角度考虑。应采取的措施是 _________________________________。
②指导教师认为乙组同学进行的两个实验中。有一个实验所得结论是不可靠的。你认为不可靠的实验选用的反应物是________,该实验所得结论不可靠的原因是______________。
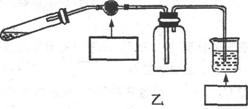 (3)丙组同学拟设计一个制取并收集较纯净的NO2气体,用来探究“NO2能否支持燃烧”的实验。图乙是丙组同学设计的制取并收集较纯净的NO2气体的实验装置。
(3)丙组同学拟设计一个制取并收集较纯净的NO2气体,用来探究“NO2能否支持燃烧”的实验。图乙是丙组同学设计的制取并收集较纯净的NO2气体的实验装置。
①丙组同学制取NO2的化学方程式是______。 ②请在图中的方框内注明图乙部分装置中所用试剂。
选做部分
共8个题,考生从中选择2个物理题、一个化学题和一个生物题作答
29.(14分)原子经济性是衡量化学反应绿色化的重要指标,原子经济性用原子利用率来衡量,原子利用率等于目标产物质量与产物总质量之比。硫代硫酸钠晶体俗称海波(Na2S2O3·5H2O)或大苏打,它是化学上重要的氧化还原反应的滴定剂,下图是工业上某种制备硫代硫酸钠的流程示意图。已知M为黑色固体纯净物,只含有两种元素,且两种元素质量比为7:4;反应(V)的化学方程式为Na2SO3+S=Na2S2O3。
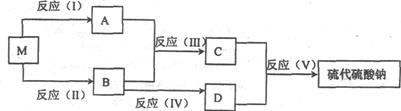
(1)写出反应(I)的离子方程式:______________________________________________。
(2)写出反应(Ⅱ)的化学方程式:_____________________________________________。
(3)反应(V)中,当有1molNa2S2O3生成时,转移的电子总数为_____________________。
(4)反应(I)和反应(II)中投入M的物质的量之比为_____________时,符合绿色化学的要求;理论上,1molM最多能制取Na2S2O3·5H2O的质量为________。
28.(14分)在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)-2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
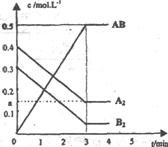 (1)该反应进行到__________时达到平衡,用AB表示的平均反应速率为:__________(分数表示)。
(1)该反应进行到__________时达到平衡,用AB表示的平均反应速率为:__________(分数表示)。
(2)图中对应的a的数值是_________,该反应的化学平衡常数Kc=__________(保留分数)。温度升高Kc值___________(填“增大”、“减少”或“不变”)。
(3)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在上图中画出4min-5min的AB浓度的变化线。
(4)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向__________方向进行(填“正反应”或“逆反应”)。判断依据是__________________________________;反应达到平衡后,各物质的体积分数与原平衡相比___________(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
15.某学生设计如下图的方法对A盐进行鉴定
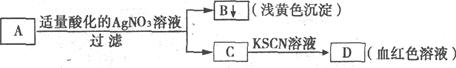
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
第Ⅱ卷(必做l20分十选做32分,共152分)
必做部分
14.常温下经测定某溶液中离子只有Na+、Ac-、H+、OH-四种,且离子浓度大小的排列顺序为:c(Ac-)>c(Na+)>c(H+)>c(OH-)。其可能的情形是
①该溶液由pH=3的HAc与pH=11的NaOH溶液等体积混合而成 ②0.2mol·L-1的HAc溶液与0.1mol·L-1的NaOH的溶液等体积混合 ③该溶液由0.1mol·L-1的HAc溶液与等物质的量浓度等体积的NaOH溶液混合而成
A.① B.② C.①② D.①②③
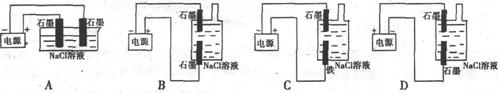
13.某学生欲制作一种家用环保型消毒液发生器,下列是他所设计的装置,你认为比较合理的是
12. 我国镍氢电池居世界先进水平,国产大功率镍氢动力电池已广泛用于我海军潜艇。常见镍氢电池的某极是储氢合金LaNi5,电池的总反应为:
我国镍氢电池居世界先进水平,国产大功率镍氢动力电池已广泛用于我海军潜艇。常见镍氢电池的某极是储氢合金LaNi5,电池的总反应为:
LaNi5H6+6NiO(OH) LaNi5+6Ni(OH)2(LaNi5H6中各元素化合价均为零),下列说法正确的是
A.放电时储氢合金作正极
B. 充电时储氢台金作阴极
C.放电时负极反应:LaNi5H6+6OH-=LiNi5+6H2O+6e-
D.充电时阴极反应:Ni(OH)2+OH--e-=NiO(OH)+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com