
3.下列是几种原子的基态电子排布,原子半径最大的原子是
A.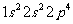 B.
B.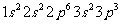
C.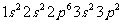 D.
D.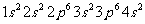
2.有关苯分子中的化学键描述正确的是
A.每个碳原子的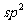 杂化轨道中的其中一个形成大
杂化轨道中的其中一个形成大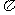 键
键
B.每个碳原子的未参加杂化的2p轨道形成大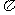 键
键
C.碳原子的三个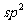 杂化轨道与其它形成三个
杂化轨道与其它形成三个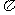 键
键
D.碳原子的未参加杂化的2p轨道与其它形成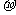 键
键
1.下列哪种物质本身所具有的能量最低
A.HI B.HBr C.HCl D.HF
28.(6分)由第ⅡA族金属单质A和第ⅢA族金属单质B组成的混合物1.299,用过量的盐酸使其完全溶解后生成的氢气在标况下的体积为1.456L.若A和B的相对原子质量之比为8:9,混合物中A和B的原子个数比为2:3,求A、B的相对原子质量。
27.(4分)实验室若配制浓度较大的碘水,一般是将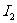 溶于
溶于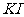 溶液中,原因是发生了如下反应:
溶液中,原因是发生了如下反应: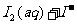


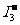 。由于
。由于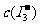 远大于
远大于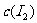 ,所以该溶液的颜色较单纯的碘水更深。上述平衡体系中,
,所以该溶液的颜色较单纯的碘水更深。上述平衡体系中,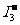 的物质的量浓度
的物质的量浓度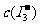 与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。
与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。
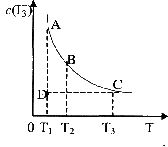
(1)A状态与C状态的化学反应速率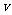 (A)________
(A)________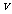 (C)。
(C)。
(2)D点所示状态,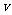 (正)_______
(正)_______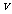 (逆)。
(逆)。
26.(8分)在一恒容密闭容器中发生某化学反应2A(g) 
 B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在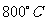 ,实验Ⅲ在
,实验Ⅲ在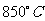 ,B、C的起始浓度都为0,反应物A的浓度(mol·
,B、C的起始浓度都为0,反应物A的浓度(mol·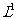 )随时间(min)变化如图所示,请同答:
)随时间(min)变化如图所示,请同答:
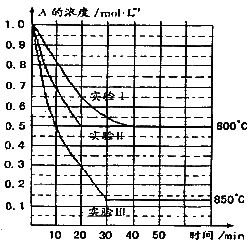
(1)根据实验Ⅲ与实验Ⅰ比较,可推测2A(g)
 B(g)+C(g)的正反应为_____(选填“放热”或“吸热”)反应。
B(g)+C(g)的正反应为_____(选填“放热”或“吸热”)反应。
(2)在实验Ⅰ中,反应在20min至30min内A的平均反应速率为_______。
(3)实验Ⅱ与实验Ⅰ比较,可能隐含的反应条件是________。
(4)与实验Ⅰ比较,若将实验Ⅰ中A的起始浓度改为1.5mol·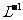 ,其他条件不变,则达到平衡时,所用时间________实验Ⅰ(选填“<” “=”
“>”“无法确定”)
,其他条件不变,则达到平衡时,所用时间________实验Ⅰ(选填“<” “=”
“>”“无法确定”)
25.(6分)将洁净的金属片Fe、Zn、A、B分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
|
金属 |
电子流动方向 |
电压Ⅳ |
|
Fe |
Fe→CU |
+0.78 |
|
Zn |
Zn→CU |
+1.10 |
|
A |
Cu→A |
一0.15 |
|
B |
B →Cu |
+0.3 |
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越______(填“大”、“小”)。Zn、A、B三种金属活动性由强到弱的顺序是________。
(2)Cu与A组成的原电池,________为负极。
24.(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
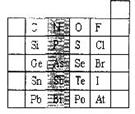
(1)阴影部分元素Bi属于________(填“金属”或“非金属”)元素,这种元素的主要化合价有_________。
(2)在一定条件下,S与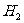 反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与Hi反应的限度(选填“更人”、“更小”或“相同”)
反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与Hi反应的限度(选填“更人”、“更小”或“相同”)
(3)O、H形成的四原子核分子甲(甲是一种常见的“绿色氧化剂”)的电子式为_____
(4)已知在一定条件下,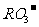 与
与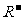 发生如下反应:
发生如下反应: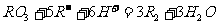 ,下列关于.R元素的叙述,正确的是( )
,下列关于.R元素的叙述,正确的是( )
A.R位于VA族 B.R的氢化物的水溶液属于强酸
C.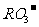 的R只能被还原 D.
的R只能被还原 D.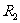 在常温常压下一定是气体
在常温常压下一定是气体
23.(4分)①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:
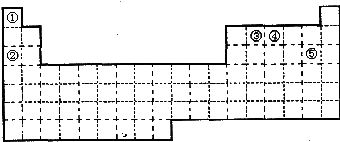
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)上述五种元素中,金属性最强的元素在周期表中的位置是_________,
(3)元素①和③可以形成众多的化合物,其中最简单的是(写化学式)________,该化合物中,化学键的类型为________(填“离子键”或“共价键”)。
22.(4分)为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
实验一:向盛有饱和氯水的锥形瓶中加入大理石,并充分振荡,观察到氯水的黄绿色 褪去并同时产生少量气体。
实验二:取上述实验一后锥形瓶中清液,进行如下实验:
(1)该清液滴在有色布条上有极强的漂白作用。
(2)该清液中滴加碳酸钠溶液产生白色沉淀。
回答下列问题:
(1)在实验二中,清液滴在有色布条上有漂白作用说明该清液中有_______(写化学式),该物质在原饱和氯水中的浓度_______(选填>、=或<)它在该清液中的浓度。
(2)在实验二中,清液中滴加碳酸钠溶液产生白色沉淀说明该清液中含有______离子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com