
1.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.5.6g铁与足量盐酸反应转移的电子数为0.3NA
B.100mL2.0mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA
D.常温常压下,20g重水(D2O)中含有的电子数为10NA
21.(8分)(1)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
①请写出并配平该氧化还原反应的方程式:
②反应中硝酸体现了 、 性质,若产生0.15mol的气体,则转移电子 mol。当用一定量的甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,其原因可能是: 。
(2)用CH4等催化还原NOx可以消除氮氧化物的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ·mol-1
①请写出CH4与NO气体反应生成N2(g)、CO2(g)、H2O(g)的热化学反应方程式:
;
②若用标准状况下3.36L CH4还原NO、NO2的混和气体至N2,可放出的热量144.7kJ,则混合气体中NO、NO2的体积比为 。
(3)高铁酸盐[FeO42-]是新一代水处理剂,其制备方法有次氯酸盐氧化法(湿法):该法是在碱性溶液中,利用次氯酸盐氧化三价铁盐(如Fe2(SO4)3)得到,试写出并配平这一反应的离子方程式 。
20.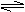 (15分)德国人哈件在18905年发明的合成氨反应原理为:N2(g)+3H2(g) 2NH3
(15分)德国人哈件在18905年发明的合成氨反应原理为:N2(g)+3H2(g) 2NH3
(g);已知298K时:△H=-92.4kJ·mol-1 △S=-198.2J·K-1·mol-1
试回答下列问题:
(1)请根据正反应的焓变和熵变计算分析298K下合成氨反应能否自发进行(保留一位小数) ;在298K时,将10mol N2和30mol H2放入合成塔中,为何放出的热量小于924kJ? 。
(2)如图在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答:
①N2的转化率αA为 。
②在状态A时,平衡常数KA= (代入数值的表达式,不要求得出具体数值)
当温度由T1变化到T2时,KA KB(填“>”、“<”或“=”)
(3)在实际工业合成氨生产中采取的措施是 (填序号)
A.采用较低压强
B.采用700K左右的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
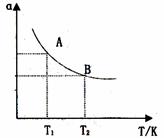
(4)下图是实验室模拟工业法合成氨的简易装置。
简述检验有氨气生成的方法 。
在1998年然腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。阴极的电极反应式 。
19.(14分)现有下列第2、3周期元素性质的部分数据,其中X数值是表示不同元素的原子在分子内吸引电子的能力大小,若X值越大,元素的非金属性越强,金属性越弱。X值相对较大的元素在所形成的分子中化合价为负价。
 元素编号 元素编号元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
|
X |
3.44 |
2.55 |
0.98 |
2.04 |
2.19 |
3.16 |
0.93 |
3.04 |
1.61 |
|
|
常 见 化合价 |
最高价 |
|
+4 |
+1 |
+3 |
|
|
+1 |
|
+3 |
|
最低价 |
-2 |
|
|
|
-3 |
-1 |
|
-3 |
|
(1)写出元素⑥在周期表中的位置 ;⑦⑥①三种元素可形成一种常见的具有消毒、杀菌作用的物质,该物质的化学式为 ,其物质对应的酸性比②的含氧酸的酸性 (填“强”、“弱”),试通过一个简单的实验加以证明,写出该反应的化学方程式 。
(2)上述元素中属于第2周期的,其元素原子半径由大到小的顺序是 (填序号)
(3)⑧的气态氢化物在一定条件下可与①的单质反应,试写出反应的化学反应方程式:
。
(4)将8g元素②的单质在足量的元素①的单质中燃烧,所得气体通入1L 1mol·L-1的NaOH溶液中,完全吸收后,溶液中离子浓度的大小顺序是 。
18.(17分)下图所示的实验装置(加热、夹持仪器省略)在化学实验中有着很多重要作用,用它可以进行一系列的实验,实验时将药品A逐滴加入到固体B中,请回答下列问题:
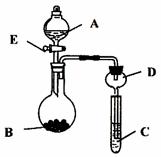
(1)实验前检查该装置的气密性的方法是 。
D装置在实验中的作用是 。
(2)若A为浓硫酸,C中盛有品红溶液褪色,则固体B可以是(填物质的名称,至少要写出3种) 。
(3)A为浓氨水,B为烧碱,C中盛有AlCl3溶液,旋开活塞E,足够长时间后,观察到C中的现象为 ,C中反应的离子方程式为:
。
若A为30%的H2O2溶液,B为二氧化锰,C中盛有饱和的硫化氢溶液,旋开活塞E后,观察到C中的现象为 ,C中发生反应的化学方程式为:
。
(4)利用上述装置还可以验证物质的性质,如设计实验证明氧化性:KMnO4>Cl2>Br2,则A中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。
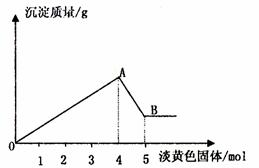
(5)溶液A中可能含有Mg2+、Cu2+、Al3+、Fe‑3+四种阳离子(阴离子 Cl-),B为淡黄色固体,旋开E后,有气体放出和白色沉淀产生,淡黄色固体的物质的量与产生沉淀的物质的量的关系如下图所示,则溶液中含有的阳离子有 ;写出图中曲线AB段反应的离子方程式 ;求溶液中存的阳离子的物质的量浓度之比 。
17.CaCO3与稀盐酸反应(放热反应)生成CO2的浓度与反应时间的关系如图所示。下列结论不正确的是 ( )
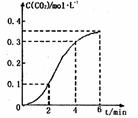
A.反应开始2min内平均反应速率最大
B.可用c(Ca2+)或c(H+)的变化表示该反应速率
C.反应开始4min内温度对反应速率的影响比浓度大
D.反应在第2min到第4min间生成CO2的平均反应
速率为v(CO2)=0.1mol·(L·min)-1
|
16.科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的。已知在25℃,105 Pa时,1mol C(石墨)完全燃烧生成CO2气体,放热393.5kJ,1mol CO完全燃烧生成CO2气体,放热283.0kJ。下列说法正确的是 ( )
A.在25℃,105 Pa时,C(石墨)燃烧生成CO气体的热化学方程式是:
2C(石墨)+O2(气)=2CO(气);△H=-110.5kJ/mol
B.C(石墨)不完全燃烧,生成CO2和CO混合气体时,放热283.0kJ
C.C(石墨)和CO2(气)生成CO(气)的反应是吸热反应
D.如果金刚石的燃烧热(1mol物质完全燃烧生成稳定的化合物所放出的热量)大于
石墨的燃烧热,则可以断定从石墨转化为金刚石需放热。
15.同温度下,在一容积可变的容器中,反应
 2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量如下调整,可使平衡右移的是 ( )
2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量如下调整,可使平衡右移的是 ( )
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
14. 如图所示,某刚性绝热容器内有一活塞和弹簧,B为真空,A内已充入2mol SO2和1mol O2,在一定条件下发生可逆反应2SO2+O2 2SO3;△H=-a kJ/mol,(a>0)一段时间后活塞已保持静止,SO2的反应速率为V0,△H1=-b(b>0)。再往A内迅速充入2mol SO2和1mol O2,当活塞再次保持静止时,SO2的反应速率为V,△H2=-c(c>0)。在此过程中,下列说法正确的是 ( )
如图所示,某刚性绝热容器内有一活塞和弹簧,B为真空,A内已充入2mol SO2和1mol O2,在一定条件下发生可逆反应2SO2+O2 2SO3;△H=-a kJ/mol,(a>0)一段时间后活塞已保持静止,SO2的反应速率为V0,△H1=-b(b>0)。再往A内迅速充入2mol SO2和1mol O2,当活塞再次保持静止时,SO2的反应速率为V,△H2=-c(c>0)。在此过程中,下列说法正确的是 ( )
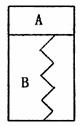
A.活塞先下移,后上移到原静止位置,V>V0, c=b
B.活塞先下移,后上移到原静止位置,V=V0, b>c
C.活塞先下移,后上移但不到原静止位置,V>V0, b<c
D.活塞先下移,后上移但不到原静止位置,V=V0, b=c
13.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
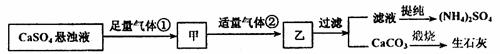
下列推断不合理是 ( )
A.生成1mol (NH4)2SO4至少消耗2mol CO2
B.气体①是NH3,气体②是CO2
C.CO2可被循环使用
D.农业上过量使用(NH4)2SO4会造成土壤酸化和板结
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com