
8.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C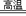 2AlN+3CO,下列叙述正确的是 ( )
2AlN+3CO,下列叙述正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2mol AlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3价
D.氮化铝晶体属于分子晶体
|
|
 H3O++S2-
H3O++S2-
B.钠与CuSO4溶液反应:2Na+Cu2+==Cu+2Na+
C.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O==CaCO3↓+2H+
D.澄清石灰水跟盐酸反应:H++OH-==H2O
7.下列化合物与小苏打溶液反应,没有气体或沉淀生成的是 ( )
A.烧碱 B.硫酸氢钠 C.氢氧化钡 D.过氧化钠
24、将2.5克碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶于水制成稀溶液,然后向该溶液中逐滴加入1mol/L盐酸。所加入盐酸溶液的体积与产生二氧化碳(标准状况)的关系如图所示。
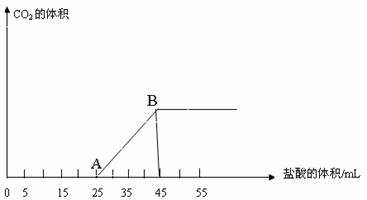
 写出OA段所发生反应的离子方程式:
。
写出OA段所发生反应的离子方程式:
。
(1)当加入35mL 盐酸时,所产生的二氧化碳的体积(标准状况)是 。
(2)计算原混合物中Na2CO3的质量分数。
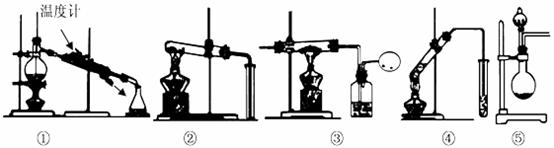
23、(8分)(1)以下均为中学化学中的常见实验装置,下列有关说法正确的是___ __。
A.装置①,用于分离沸点不同的两种液态有机物
B.装置②,可用于鉴别碳酸钠与碳酸氢钠两种固体
C.装置③,可用于CO还原氧化铁实验
D.装置④,适用实验室制取少量乙炔
E.装置⑤,选择合适药品时,可用于制备少量氨气及氧气等
(2)欲量取20.00mL Na2CO3溶液,应选用的仪器是_________________。
(3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、____________________。
(4)在测定硫酸铜晶体中结晶水含量的实验中,称量操作至少要进行__________次。
22、(8分)单质A、B、C在常温下均为气态,分别由X、Y、Z
三种短周期元素组成;Z元素的原子次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色固体。各物质间的转化关系如下图所示(反应条件多数已略去);
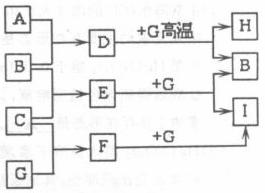
(1)写出D分子的电子式 。
(2)G与D在高温下反应的化学方程式为 。
(3)以石墨为电极电解E的水溶液,其阳极电极反应式为 。
(4)实验室检验F的水溶液中所含金属阳离子的操作方法、现象和结论是 。
21、(12分)北京市场销售的某种食用精制盐包装袋上有如下说明:
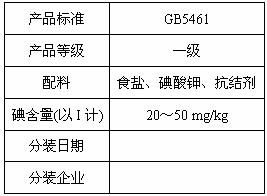 (1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是________________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是____________________________________。
(3)已知:I2+2S2O32 - = 2I-+S4O62 -。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是__________________________________________。
②b中反应所产生的I2的物质的量是________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_________________mg/kg。
20、(16分)A、B、C、D、E为五种常见短周期元素,常温下A、B可形成两种液态化合物,其最简式分别为BA和B2A,B与D既可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱恰好相反;C元素的焰色反应呈黄色;E与C同周期,且E的阳离子在其所在周期元素形成的简单离子中半径最小,试回答:
(1)D元素处于周期表的 族。
(2)最简式为BA对应的化合物的结构式为 ,Y的电子式为 。
(3)液态X类似B2A,也能微弱电离产生电子数相同的两种离子,则液态X的电离方程式为 。
(4)A、D、E三种元素形成的盐(化学式为A9D3E)的水溶液呈 性,用离子方程式解释其原因 。
(5)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,W的水溶液呈碱性,Q的水溶液呈酸性,且物质的量浓度相同的W、Q溶液中水的电离程度:前者小于后者,则W ,Q 。(填化学式)
19、(4分)铍是一种高效率的火箭燃料,铍在燃烧时能释放出巨大的能量:每千克铍完全燃烧放出的热量为62700kJ。
(1)写出铍燃烧的热化学方程式: 。
(2)氧化铍与Al2O3性质相似,写出BeO与盐酸反应的离子反应方程式:
18、将0.2mol KMnO4在一定温度下加热生成a mol O2;将剩余固体与过量浓盐酸混合加热又生成 b mol Cl2 ,此时锰元素均以Mn2+形式存在。若a + b = m, 则m的值可能为
A.0.30 B.0.40 C.0.50 D.0.60
17、分析化学中常用X射线研究晶体结构.有一种蓝色晶体可表示为:
[ M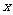 Fe
Fe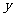 (CN)
(CN)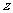 ],研究表明它的结构特性是:
],研究表明它的结构特性是: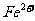 和
和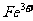 分别占据互不相邻的立方体的顶点,而
分别占据互不相邻的立方体的顶点,而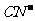 位于立方体的棱上。其晶体中的部分离子的空间结构关系如图所示,下列说法正确的是
位于立方体的棱上。其晶体中的部分离子的空间结构关系如图所示,下列说法正确的是
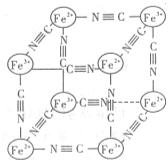
A.该晶体属于原子晶体
B.该晶体的化学式为MFe2((CN)6
C.M的离子位于上述立方体的体心,呈+1价
D.该晶体属于离子晶体,M呈+2价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com