
6、下列离子方程式正确的是
A.向含0.5mol溴化亚铁溶液中通入0.5mol氯气 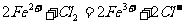
B.二氧化硫气体通入溴水:SO2+Br2+2H2O== 4H++SO42-+2Br-
C.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全
Ba2++ 2OH- + 2 H+
+ SO 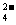 = BaSO4↓ + 2H2O
= BaSO4↓ + 2H2O
D.向Ca(ClO)2溶液中通入适量SO2 Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓ + 2HClO
5、关于氢键,下列说法正确的是
A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
B.氯化钠易溶于水是因为形成了氢键
C.氨易液化与氨分子间存在氢键无关
D.H2O是一种非常稳定的化合物,这是由于氢键所致
4、下列叙述正确的是
A.复分解反应不一定不是氧化还原反应
B.只有一种生成物的化学反应不一定是化合反应
C.有阳离子存在的物质中一定存在阴离子
D.离子反应一定是复分解反应
3、 新华社2007年3 月21日电,全国科学技术名词审定委员会21日公布:111号元素(符号为Rg)的中文名称为“ 钅仑 ”。下列说法正确的是:
A.111号元素是第6周期、第ⅠA族的金属元素
B.111号元素属于过渡元素
C.111号元素为非金属元素
D.111号元素质量分数为111
2、 某物质经分析知其中仅含一种元素,此物质是
A.一定是一种单质 B.一定是一种纯净物
C.一定是混合物 D.可能是纯净物也可能是混合物
1、 图标所警示的是

A.当心火灾--易燃物质 B. 当心火灾--氧化物
C.当心爆炸--自燃物质 D. 当心爆炸--爆炸性物质
18.(12分)、(1)配平氧化还原反应方程式:
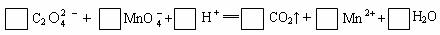
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL 溶
液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H 的物质的量为 mol。
的物质的量为 mol。
②第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16mL时反应完全,此时溶液颜色由 变为___________。该溶液中还原剂的物质的量为___________mol。
③原试样中H2C2O4·2H2O的质量分数为______________________,KHC2O4的质量分数为______________________。
17.(12分)、现有一定量含有NaCl杂质的NaHCO3试样。某同学选用下列实验装置来测定NaHCO3试样的纯度 (连接胶管省略) 。
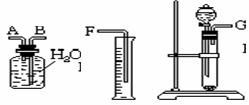
请填写下列空白:
(1)装置的连接顺序应是(填各接口的字母;连接胶管省略)
(2)装置中的水应改用 ,因此分液漏斗中的酸应选用 。
(3)为使气体体积测量准确,实验中要注意的问题有
(4)已知实验时取用样品量为mg,实验测得气体体积为VL (已转换为标准状况),则试样中NaHCO3纯度约为 ×100% (只填算式,不必化简)
(5)请你再设计一个测定该试样纯度的实验方案
16.(14分)2007年,美国爆发宠物食品受污染事件。事后调查表明:掺杂了≤6.6%三聚氰
胺的小麦蛋白粉是宠物食品导致中毒的原因。
2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因也是奶粉中含有三聚氰胺。
三聚氰胺是一种重要的氮杂环有机化工原料,分子式C3N6H6。动物长期摄入三聚氰胺会造成生殖、泌尿系统的损害,膀胱、肾部结石,并可进一步诱发膀胱癌。
(1)三聚氰胺最早被李比希于1834年由电石(CaC2)合成。
电石与水反应生成的气体的燃烧热为Q kJ/mol,请写出该气体燃烧的热化学方程式
目前工业上较多采用尿素[CO (NH2)2]在催化剂以及380-400℃温度下发生分解反应,生成三聚氰胺及一种酸性气体和一种碱性气体。
反应的化学方程式为:
(2)由于食品和饲料工业蛋白质含量测试方法的缺陷,三聚氰胺也常被不法商人用作食品添加剂,以提升食品检测中的蛋白质含量指标,因此三聚氰胺也被人称为“蛋白精”。蛋白质主要由 缩聚而成,其含氮量平均约为20%,而三聚氰胺含氮百分量为 (保留小数点后两位)。通用的蛋白质测试方法“凯氏定氮法”是通过测出含氮量来估算蛋白质含量,因此,添加三聚氰胺会使得食品的蛋白质测试含量偏高,从而使劣质食品通过食品检验机构的测试。每100g牛奶中添加0.1克三聚氰胺,就相当于 g(保留小数点后两位)蛋白质。
(3)已知三聚氰胺分子结构对称且分子中含有3个氨基(-NH2)和类似苯环的结构,请写出它的结构简式:
(4)据你推测,下列物质能与三聚氰胺反应的是:
A.盐酸 B.氢氧化钠 C.氢气 D.三氯化铁
15.(8分)、某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内。

(2)反应中,被还原的元素是 ,还原剂是 。
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com