
0.05 mol·L-1AgNO3溶液中的溶解度分别为S1、S2、S3、S4,则S1、S2、S3、S4由大到小的顺序为 。
(2)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
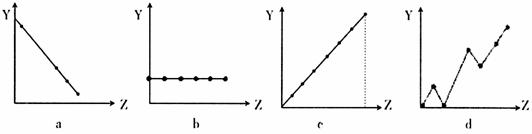
①ⅡA族元素的价电子数 ;
②第3周期元素的最高化合价 ;
③F-、Na+、Mg2+、Al3+的离子半径 。
(3)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物的水化物的化学式为 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为 ,B的化学式为 。
③工业上制取单质M的化学方程式为 。
26.(11分)(1)若AgC1在水中、0.01 mol·L-1 CaCl2溶液中、0.01 mol·L-1 NaCl溶液中及
25.(12分)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H2O(g) CO+H2;
②CO+H2O(g)
CO+H2;
②CO+H2O(g)  CO2+H2
;
CO2+H2
;
(1) 已知CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol ;
H2(g)+1/2O2(g)=H2O(g); △H=-285.8kJ/mol;写出上述CO与H2O(g)反应的热化学方程式。
(2) 从反应混合物中分离出H2的方法通常是以碱液洗气,根据该工业生产的实际分析,最好选用下列哪种溶液作为吸收剂? ,理由是 。
A.氢氧化钠溶液 B.氨水 C.石灰水或石灰乳
(3) 在实验室模拟上述反应②,830℃时在1L的容器中装入CO和H2O(g)各2mol使之反应,达到平衡时测得容器中CO2的浓度为1mol/L,计算830℃时该反应的平衡常数。
24.(8分)已知铜氨溶液中存在如下平衡:[Cu(NH3)]42+ Cu2++4NH3。
Cu2++4NH3。
某一混合液含有Ag+、Fe3+和Al3+,可以下列流程图加以分离和鉴定。
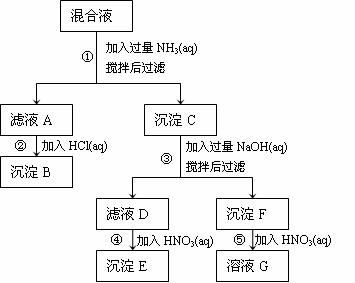
(1)写出滤液A中主要的阳离子的化学式 。
(2)解释步骤②中生成沉淀B的原因 。
(3)写出步骤③中发生反应的离子方程式 。
(4)溶液G中的金属离子的鉴定方法 。
23.(12分)下面是甲、乙两同学对草酸受热分解及其产物的检验做的探究:
甲、乙两同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
|
名称 |
分子式 |
颜色、状态 |
溶解性 |
|
熔点(℃) |
密度(g/cm3) |
|
草酸 |
H2C2O4 |
- |
易溶于水 |
|
189.5 |
1.900 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
- |
|
101.5 |
1.650 |
备注:草酸晶体失去结晶水后,175℃以上开始分解。
(1) 猜想与假设:
第一种:草酸分解产物是CO2和H2;
第二种:草酸分解产物是CO2、CO和H2O;
第三种:草酸分解产物是CO2和H2O。
(2) 实验装置的设计(图中铁架台略去)甲同学设计了如图1所示的装置。乙同学设计了如图2所示的装置。
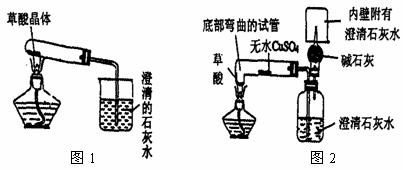
(3) 实验:
甲同学按图(1)装置实验,观察到澄清石灰水变浑浊,……
乙同学按图(2)装置实验,观察到:
A、无水CuSO4变蓝;
B、广口瓶中澄清石灰水变浑浊;
C、生成的气体通过碱石灰后,在尖嘴处点燃后能燃烧,在火焰上方罩一个内壁附有澄清石灰水的烧杯,澄清的石灰水变浑浊。证明产物中有 。
(4) 结论:
第 种猜想是正确的,请写出草酸受热分解的化学反应方程式
。
(5) 反思与评价
乙同学认为甲同学设计的实验装置有缺陷。由于试管口向下倾斜,而且草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中常会出现熔融的草酸流进导管而影响后续实验。甲同学认为乙同学的设计是科学合理的。请你谈谈图2装置优于图1装置之处:
第一点: 。
第二点: 。
第三点: 。
乙同学设计的图2装置也能证明产物中无H2,证明方法是
。
22.(12分)用下图装置进行SO2转化为SO3的转化率测定实验:2SO2+O2 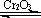 2SO3 △H=-196.6kJ/mol
2SO3 △H=-196.6kJ/mol
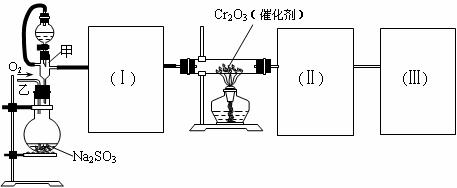
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接1个合适的装置,请从下列A~E中选择适宜的装置,将其序号填入空格内。
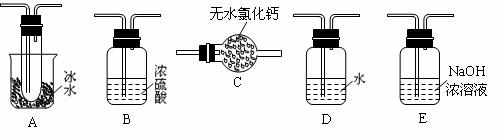
Ⅰ 、Ⅱ 、Ⅲ 。
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是: 。
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是 若用大火加热有Cr2O3处的反应管时,SO2的转化率会 (填升高、降低或不变)
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中SO2的转化率为 。(保留3位有效数字)
21.(6分)现有CuO、CuS、Cu2S三种黑色粉末,请设计一个不用化学药品就可区分它们的实验方案。(请用文字叙述)
|
步骤 |
操作过程 |
实验现象 |
结论 |
|
① |
称取等质量的CuO、CuS、Cu2S粉末各一份, |
/ |
/ |
|
② |
|
|
|
|
③ |
|
|
|
20.用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是
A.阳极上析出5.6 mL O2(标准状况) B.阴极上析出32 mg Cu
C.阴极上析出11.2 mL H2(标准状况) D.阳极和阴极质量都无变化
19.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D.标准状况下,a L甲烷和乙烷混合气体中的分子数约为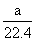 ×6.02×1023
×6.02×1023
18.铜与1mol/L的硝酸反应,如果NO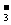 浓度下降0.2mol/L,则溶液中c(H+)同时下降(溶液体积变化忽略不计)
浓度下降0.2mol/L,则溶液中c(H+)同时下降(溶液体积变化忽略不计)
A.0.2mol·L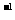 B.0.4mol·L
B.0.4mol·L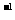 C.0.6mol·L
C.0.6mol·L D.0.8mol·L
D.0.8mol·L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com