
31.某天然碱(纯净物)可看作由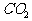 和
和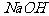 反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生
反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生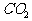 的体积(标准状况)见下表:
的体积(标准状况)见下表:
|
|
I |
II |
III |
IV |
|
盐酸溶液的体积/mL |
30 |
30 |
30 |
30 |
|
样品/g |
3.32 |
4.15 |
5.81 |
7.47 |
|
二氧化碳的体积/mL |
672 |
840 |
896 |
672 |
(1)由第I组数据中的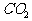 体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生
体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生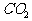 _________mL(标准状况)。
_________mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时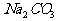 不分解),产生
不分解),产生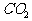 112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(3)已知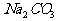 和
和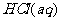 的反应分下列两步进行:
的反应分下列两步进行:
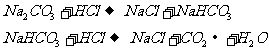
由表3中第IV组数据可以确定所用的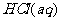 的浓度为_________mol/L。
的浓度为_________mol/L。
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验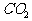 (标准状况)体积V(mL)与样品质量W(g)之间的关系式。(写出简要计算步骤)
(标准状况)体积V(mL)与样品质量W(g)之间的关系式。(写出简要计算步骤)
30.黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:

在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量。试回答下列问题。
(1)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度。(写出简要计算步骤)
(2)计算出该固体聚合硫酸铁样品的化学式。(写出简要计算步骤)
29.BAD是一种紫外线吸收剂,其合成方法如下:
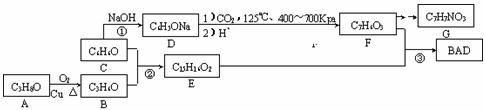
已知:
Ⅰ.B分子中所有H原子的化学环境相同;
Ⅱ.BAD的结构为:
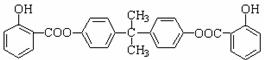
请回答下列问题:
(1)A的名称为 。
(2)F的结构简式为 。F的一些同分异构体能使氯化铁溶液变色,能发生银镜反应,且苯环上的一硝基取代产物有两种。符合上述条件的同分异构体有 种。
(3)反应②的化学方程式为 ________________________________________;
反应③在一定条件下能直接进行,其反应类型为 。
(4)1molBAD与足量NaOH溶液作用,最多能消耗________molNaOH。
(5)G是一种氨基酸,且羧基和氨基处于苯环的对位。写出G缩聚产物可能的结构简式两种 ______ ,__________________________
28.(1)已知烯烃、炔烃在臭氧作用下发生以下反应:
CH3 -CH=CH-CH2-CH=CH2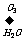 CH3 CHO + OHC-CH2CHO + HCHO
CH3 CHO + OHC-CH2CHO + HCHO
CH3 -C≡C-C≡CH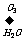 CH3 COOH + HOOC-COOH + HCOOH
CH3 COOH + HOOC-COOH + HCOOH
①化学式为C10H10的某烃,在臭氧作用下发生反应为:
C10H10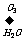 CH3 COOH + 3HOOC-CHO + CH3CHO
CH3 COOH + 3HOOC-CHO + CH3CHO
则此C10H10的结构简式为: 。
②有人尝试合成C10H10的饱和烃,你估计若能成功的话,其结构如何?试用线条表示分子中“碳架”的空间构型(不必写出C、H符号)
(2)催化剂的研究使得许多物质出现新的化学反应。例如 2分子烯烃A在苯中用一特殊催化剂处理时生成两种新的烯烃B和C。
2A 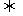 B + C
B + C
填空或回答下列问题:
①若A为RCH=CHR’,B为RCH=CHR,写出上述化学方程式:
②对上述反应提出两种反应机理(竖线表示断键位置)
机理a是
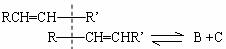
则机理b是
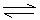
③根据课本学过的知识回答:采用何种方法能证明反应机理是a或b?
答:
27.磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。
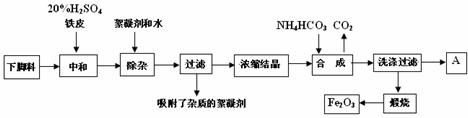
已知煅烧中的化学反应方程式为:FeCO3 → FeO + CO2↑,4FeO + O2 → 2Fe2O3
(1)用98%的浓H2SO4配制500mL20%的H2SO4,所需玻璃仪器除胶头滴管、一定规格量筒外,还需要的仪器是 ( )
A、玻璃棒 B、烧杯 C、漏斗 D、250mL容量瓶
E、500mL容量瓶
(2)浓缩结晶后得到的晶体是 (填化学式),A中溶质是 ;
此溶液中各离子的浓度比较大小为: 。
(3)20%H2SO4和铁皮的作用分别是 。
(4)检验滤液中含有NH4+的方法是
。
(5)写出步骤“合成”中发生的化学变化(用化学方程式表示):
。
26.为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
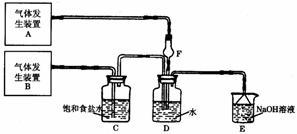
试填空:
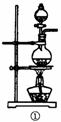
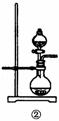
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是: ______;发生装置B应选择以下三种装置中的_____(选填序号)。

(2)D装置中主要反应的离子方程式为___________________ ________。
(3)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④ 苯酚溶液 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
若Cl2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,再加入 _______(选填一个序号)试剂,发生的现象是: _;
若SO2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,发生的现象是: ______________。
25.有A、B、C、D四种短周期的非金属元素(其单质也分别用A、B、C、D表示),原子序数按A、B、C、D顺序依次增大,A原子核外只有一种运动状态的电子,B原子核外有3个未成对电子,B、C元素在周期表中是同周期的相邻元素,D与B、C处于不同周期。
甲、乙、丙、丁、戊是以上四种元素组成的化合物,其中甲由A、C组成,乙由A、D组成,丁由A、B组成,乙的浓溶液与一种黑色粉末共热可得单质D。它们有如下的变化关系:
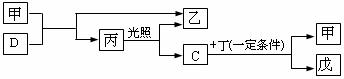
回答下列问题:
(1)元素D在周期表的位置是 ,它的原子核外共有 种不同能量的电子;
(2)上述化合物中,10电子的分子有 (写化学式);
(3)乙和丁反应后生成的物质中存在的化学键有 ;
(4)写出单质C与甲、戊反应的总化学方程式: 。
24.甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g) CH3OH(g)+Q
CH3OH(g)+Q
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 _______(填字母)。
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡____________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的理由是_____________________________________________________
________________________________________________________________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
|
CO2%-CO%-H2% (体积分数) |
0–30–70 |
2–28–70 |
4–26–70 |
8–22–70 |
20–10–70 |
|||||||||||
|
反应温度/℃ |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
|
|
碳转化率(%) |
CH3OH |
4.9 |
8.8 |
11.0 |
36.5 |
50.7 |
68.3 |
19.0 |
33.1 |
56.5 |
17.7 |
33.4 |
54.4 |
8.0 |
12.0 |
22.6 |
|
CH4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2.8 |
2.8 |
2.8 |
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:______________________________________________________________
______________________________________________________________。
23.金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”。以下是测定矿石中钒的含量的两个反应:
(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液。写出该反应的化学方程式
___________________________________________________________________;
该反应______(选填“是”或“不是”)氧化还原反应。
(2)用已知浓度的硫酸酸化的H2C2O4(H2C2O4中C为+3价)溶液,滴定(VO2)2SO4溶液,完成下列离子方程式,短线上填写物质的化学式或离子符号。
VO2+ + H2C2O4 + _____→ VO2+ + CO2 + ________
反应中做氧化剂的是__________,被还原的元素是_______________。
欲知该反应能否用盐酸酸化,还需要知道的是__________________________相对大小。
22.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL 同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
510 |
770 |
918 |
|
气体体积/mL |
560 |
672 |
672 |
则下列说法正确的是
A.甲组和乙组的实验中,盐酸均是过量的
B.盐酸的物质的量浓度为0.8 mol·L―1
C.合金中镁铝的物质的量之比为1∶1
D.丙组中铝的物质的量为0.009 mol
第二卷(共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com