
28.(15分)下图是中学化学中常见的物质间转化关系图,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G溶液为强酸性溶液,H为既难溶于水,也难溶于稀酸的白色沉淀。
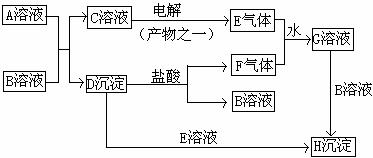
试回答:
(1)写出化学式:A ;B 。
(2)写出下列反应的离子方程式:
①C→E 。
②E+F+ H2O → G 。
(3)用电子式表示C物质的形成过程: 。
27.(16分)
Ⅰ.氯、溴、碘同在周期表中的第VII A族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3首先制得纯净的KBrO4 晶体。
(1)高碘酸盐(IO65-)能在一定条件下将Mn2+ 氧化为MnO4- ,其反应平稳而迅速,写出该离子反应方程式 。
(2)在25℃,已知pH=2的高碘酸与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol/L的碘酸或高锰酸与pH=12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是 酸;高锰酸是 酸(填“强”或“弱”)。
(3)写出XeF2 和含KOH、KBrO3 的水溶液反应得到KBrO4的离子方程式: 。
Ⅱ.现有A、B、C、D四种有机物,已知:①它们的相对分子质量都是104 ;②A是芳香烃,B、C、D均为烃的含氧衍生物,分子内均没有甲基;③A、B、C、D能发生如下反应生成高分子化合物X、Y、Z(方程式未注明条件): n A →X ,n B → Y (聚酯) + n H2O ,n C + n D → Z (聚酯) + 2n H2O 。请按要求填空:
(1)A 的结构简式是 ,A分子中处于同一平面的原子有 个。
(2)B发生分子内酯化生成E ,其化学反应方程式为 。
(3)Z的结构简式是
26.(14分)如下图是用于简单有机化合物的制备、分离、提纯的常见简易装置。请根据该装置回答下列问题:
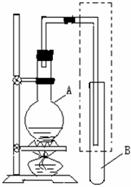
(1)若用正丙醇与乙酸反应制取乙酸正丙酯,则在烧瓶A中加入正丙醇与乙酸外,还应加入的试剂是 (填写名称),试管B中应加入 。虚线框中的导管除用于导气外,还兼有 作用。
(2)若用该装置制备溴乙烷,烧瓶A中加入NaBr晶体、乙醇和浓硫酸,试管B中加入少量水,则少量水所起的作用是 。
(3)若用该装置分离乙酸和1-丙醇,则在烧瓶A中除加入1-丙醇和乙酸外,还应先加入适量的试剂 ,加热到一定温度,试管B中收集到的是(填写化学式) 。冷却后,再向烧瓶中加入试剂 ,再加热到一定温度,试管B中收集到的是 (填写化学式)。
13.如下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是:
|
|
不纯物质 |
除杂试剂 |
分类方法 |
|
A |
蛋白质溶液(NaCl) |
蒸馏水 |
渗析 |
|
B |
NH4Cl溶液(AlCl3) |
NaOH溶液 |
过滤 |
|
C |
乙酸乙酯(乙酸) |
KOH溶液、水 |
分液 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
第Ⅱ卷(非选择题)
12.现有 Wg 某不饱和链烃R(R分子中只含单键和双键),R能与V L(标准状况)氢气恰好完全反应,生成烷烃。若R的相对分子质量为M,阿伏加德罗常数为NA ,则1molR 中含有双键数目为:
A.WVNA/22.4M B.MVNA/22.4W C.WV/22.4M D.MV/22.4W
11.在一定温度下容积恒定的密闭容器中,充入 2mol
A 、1mol B和 4mol M 发生如下反应: 2 A(g)+ B(g)+ M(s)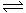 x C(g),达到平衡后C的体积分数为a%;若在相同条件下,x分别为 2或3 时,均按起始物质的量为 0.6
mol A 、0.3 mol B 、1.4 mol C、2mol
M 充入容器中,分别达到平衡状态,两平衡状态中C的体积分数为:
x C(g),达到平衡后C的体积分数为a%;若在相同条件下,x分别为 2或3 时,均按起始物质的量为 0.6
mol A 、0.3 mol B 、1.4 mol C、2mol
M 充入容器中,分别达到平衡状态,两平衡状态中C的体积分数为:
A.两者都等于a% B. 两者都大于a%
C.两者都小于a% D.无法确定
10.在室温下进行中和滴定,酸和碱恰好完全反应时,以下说法一定正确的是
A.参加反应的酸和碱的物质的量相等
B.参加反应的酸中的H+ 离子总量和碱中OH -离子总量相等
C.反应后混合液的 pH = 7
D.不能用适当的酸碱指示剂来判断
9.已知下列两个反应,前者较后者更难发生:
①Ag+ + 2NH3·H2O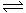 [Ag(NH3)2]+ , ②
NH3·H2O + H+ = NH4+ , 现欲使银氨溶液中产生大量的Ag+ ,应加入的适宜试剂是:
[Ag(NH3)2]+ , ②
NH3·H2O + H+ = NH4+ , 现欲使银氨溶液中产生大量的Ag+ ,应加入的适宜试剂是:
A.KOH B.NaHSO4 C.HNO3 D.HBr
8.下列离子方程式中书写正确的是:
A.铝粉溶于氢氧化钠溶液中:2Al + 2OH -+ H2O = 2AlO2- + 3 H2 ↑
B.小苏打溶液和醋酸溶液混合:HCO3- + CH3COOH = CH3COO- + CO2↑+H2O
C.硫酸铝水解使溶液显酸性:Al3+ + 3H2O = Al(OH)3↓ + 3 H+
D.向Ca(H2PO4)2溶液中加入少量NaOH 溶液:
Ca2+ + 2 H2PO4- + 2OH- = HPO4- +CaHPO4↓ + 2H2O
7.下列说法或表示方法中正确的是:
A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8KJ/mol ,则氢气燃烧的热化学方程式为
2H2(g)+ O2(g)= 2 H2O (l);△H= - 285.8KJ/mol
C.Ba(OH)2·8 H2O (s)+ 2NH4Cl (s)= BaCl 2(s)+ 2NH3(g)+10 H2O (l);△H < 0
D.已知中和热为57.3 KJ/mol ,若将含0.5 mol H2SO4的浓溶液与含 1 mol NaOH的溶液混合,放出的热量要大于57.3 KJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com