
11.一种从植物中提取的天然化合物 可用于制作“香水”,其结构为
可用于制作“香水”,其结构为
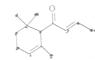 ,有关该化合物的下列说法不正确的是
,有关该化合物的下列说法不正确的是
A.分子式为C13H20O
B.该化合物可发生聚合反应
C.1 mol该化合物完全燃烧消耗19 mol O2
D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
10.已知:25 ℃时,KSP[Mg(OH)2]=5.61 10-12,KSP[MgF2]=7.43
10-12,KSP[MgF2]=7.43 10-11。下列说法正确的是
10-11。下列说法正确的是
A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的KSP比在20 mL 0.01 mol·L-1 NH4Cl溶液中的KSP小
D.25 ℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
9.已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,则下列溶液沸点最高的是
A.0.01 mol·L-1的蔗糖溶液 B.0.01 mol·L-1的CaCl2溶液
C.0.02 mol·L-1的NaCl溶液 D.0.02 mol·L-1的CH3OOH溶液
8.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5 NA
B.1 mol 乙烷分子含有8 NA个共价键
C.58.5g的氧化钠固体中含有NA个氧化钠分子
D.在1L0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1 NA
7.下列说法正确的是
A.蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化学物
B.氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用
C.使用太阳能热水器、沼气利用、玉米制乙醇都涉及到生物质能的利用
D.石油、煤、天然气、可燃冰、植物油都属于化石燃料
27.(10分)
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
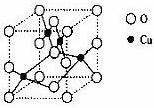
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为__________。
(2)上图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)]SO4 ·H2O,其结构示意图如下,下列说法正确的是__________(填字母)。
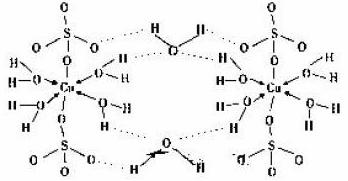
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)2]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________。
(5)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请解释原因__________。
26.(10)
光催化制氢是化学研究的热点之一。科学家利用含有呲啶环(呲啶的结构式为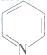
其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
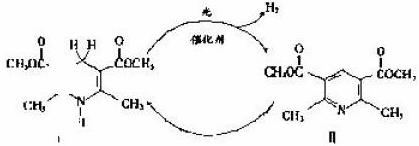
(1)化合物II的分子式为______________。
(2)化合物I合成方法如下(反应条件略,除化合物III的结构未标明外,反应式已配平);

化合物III的名称是________________。
(3)用化合物V(结构式见下图)代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为___________________。
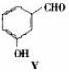
(4)下列说法正确的是_____________(填字母)
A、化合物V的名称是间羟基苯甲醛,或2-羟基苯甲醛
B、化合物I具有还原性;II具有氧化性,但能被酸性高锰酸钾溶液氧化
C、化合物I、II、IV都可发生水解反应
D、化合物V遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
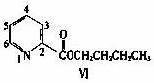
(5)呲啶甲酸酯可作为金属离子的萃取剂。2-呲啶甲酸正丁酯(VI)的结构式见下图,其合成原料2-呲啶甲酸的结构式为_________________;VI的同分异构体中,呲啶环上只有一个氢原子被取代的呲啶甲酸酯类同分异构体有_________________种。
25.(9分)
叠氮化合物应用广泛,如NaN3可用于汽车安全气囊PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件Ph-代表苯基 )
)
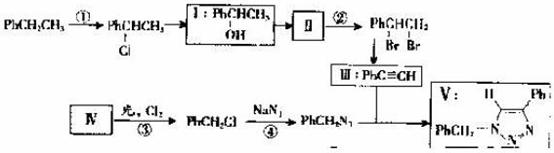
(1)下列说法不正确的是 (填字母)
A.反应①④属于取代反应
B.化合物I可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物I
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为 (不要求写出反应条件)
(3)反应③的化学方程式为 (要求写出反应条件)
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物V,不同条件下环加反应还可生成化合物V的同分异构体。该同分异物的分子式为 结构式为 。
(5)科学家曾预言可合成C(N3)4。其可分解成单质,用作炸药。有人通过NaN3与NC-CCl3反应成功合成了该物质。下列说法正确的是 (填字母)
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物Ⅲ发生环加反应
D.C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4 C+6N2
C+6N2
24.(11分)
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超Al2O3. NH4AlO(OH)HCO3细热分解的化学反应方程式为 。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mlpH为2,浓度约为0.1mol·L-1的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体 g
②将上述固体置于烧杯中
(3)在0.1 mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图
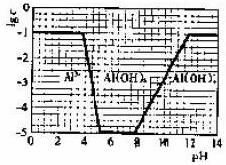
①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有
②请在答题卡的框图中,画出mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要的标注。
23、(11分)
磷单质及其化合物有广泛应用。
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)  H
H
①上述反应中,副产物矿渣可用来 。
②已知相同条件下:
4Ca3(PO4)3F(s)+3SiO2(s)==6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)
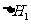
2Ca3(PO4)2(s)+10C(s)==P4(g)+6CaO(s)+10CO(g)
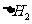
SiO2(s)+CaO(s)==CaSiO3(s)
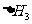
用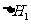 、
、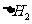 和
和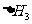 表示
表示 H,
H, H
H =
=
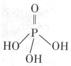
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见下图)之间脱去两个分子产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为 。
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) N12+ + H2PO-2 + → Ni+ H2PO-3 +
(b)6H2PO-2
+2H+ ===2P+4H2PO3-+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;原理上的不同点: ;化学镀的优点: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com