
7.用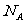 表示阿伏加德罗数的值,下列叙述正确的是 ( )
表示阿伏加德罗数的值,下列叙述正确的是 ( )
A.常温常压下,11.2 L氯气含有的分子个数大于0.5NA
B.7.8gNa2O2与足量CO2充分反应转移电子数为0.1NA
C.20g重水(D2O)中含有的中子数为8 NA
D.工业上制取28gSi需要消耗的碳原子数的为NA
6.Fe3+、SO42-、A13+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,X可能是 ( )
A.K+ B.OH- C.CO32- D.C1-
20.(8分)分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式。
说明:①不考虑同一碳原子上连两个羟基;②乙炔、苯等分子中同类原子化学环境相同,丙烷、丁烷等分子中同类原子化学环境有两种。
(1)甲分子中没有甲基,且1mol甲与足量金属Na反应生成1molH2。若甲还能与NaHCO3溶液反应,则甲的结构简式为 ;若甲还能发生银镜反应,则甲的结构简式为 。
(2)乙分子中所有同类原子的化学环境相同,且不与金属Na反应,则乙结构简式为 。
(3)丙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且丙与金属Na不反应,则丙结构简式为 。
19.(17分)存在于茶叶的有机物A,其分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种。A遇FeCl3溶液发生显色反应。F分子中除了2个苯环外,还有一个六元环。它们的转化关系如下:
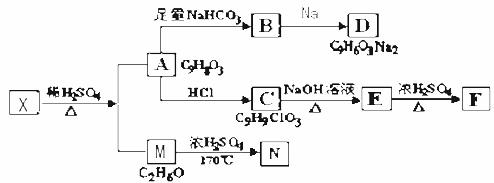
请回答下列问题:
(1)有机物A中含氧官能团的名称是____________;
(2)写出下列反应的化学方程式A→B________________; M→N:_______;
(3)A→C的反应类型为____________________,
E→F的反应类型 为___________________;
(4)通常条件下1mol A可以消耗______mol Br2
(5)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有____________种(不包括R);
(6)A→C的过程中还可能有另一种产物C1,请写出C12在NaOH水溶液中反应的化学方程式______________________________________________________。
18.(15分)实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
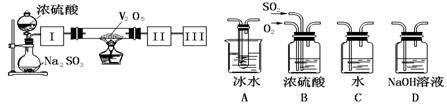
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为 。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ ,装置Ⅱ ,装置Ⅲ 。
(3)开始进行实验时,首先应进行的操作是 。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会 (填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是 ___;(用含字母的代数表示)。
17.(12分)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物。X在一定条件下可以分解成Y,X的电子式为____________,其分子属于__________(填“极性”、“非极性”)分子。D与C形成的化合物D2C2可与Y反应生成单质C, 该反应的化学方程式________________
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出工业生产单质E的化学反应方程式______________________。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8g W气体(已知n(A):n(B)=3:1),可放出18. 44 kJ热量,则该反应的热化学方程式____________,W的空间构型为_______________
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为____________________________
(5)向溴水中通入一定量的FC2气体,溶液的pH会_______(填“升高”或“降低”)
16.下列叙述正确的是
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
第II卷 (非选择题 共52分)
15.正确掌握化学用语是学好化学的基础。下列化学用语中正确的是
A.乙烯的结构简式为CH2CH2 B.葡萄糖的实验式(最简式)为C6H12O6
C.氯化铯的晶体结构(晶胞)模型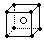 D.NH4Cl的电子式为
D.NH4Cl的电子式为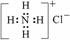
14.咖啡酸(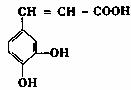 )存在于许多中药中,有止血作用,毒性较小。
)存在于许多中药中,有止血作用,毒性较小。
有关咖啡酸的说法中,正确的是
A.与浓硫酸共热能发生消去反应 B.能与FeCl3溶液发生显色反应
C.1摩咖啡酸最多只能与1mol Br2反应 D.其分子式为C9H10O4
13.下列物质呈固态时必定属于分子晶体的是
A.非金属氧化物 B.金属氧化物
C.非金属单质 D.常温下呈气态的物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com