
8.下列各组中化合物的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4 B.碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
C.稳定性:HCl>H2S>PH3 D.沸点:HF>HCl>HBr>HI
7.下列离子方程式书写正确的是( )
A.碳酸氢钙溶液加到醋酸中:
Ca(HCO3)2+2CH3COOH===CA2++2CH3COO-+2CO2á+2H2O
B.FeI2溶液中通入少量的Cl2:2Fe2++CO2====2Fe3++2CL-
C.饱和Fecl3溶液滴入沸水中:Fe3++3H2O Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:
2HCO3-+Ba2++2OH-====BaCO3â +2H2O+CO32-
6.下列各项表述正确的是
A.羟基的电子式
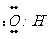 B.醛基官能团符号-COH
B.醛基官能团符号-COH
C.铝离子结构示意图: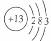 D.异丁烷的结构简式: CH3CH(CH3)CH3
D.异丁烷的结构简式: CH3CH(CH3)CH3
31.(6分)一定温度下,测得某纯水的pH为6.5。试计算:
(1)此时水的离子积常数Kw为多少?
(2)若在此纯水中加一定量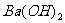 固体,配制成
固体,配制成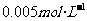 的
的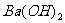 溶液,保持原温度,其溶液的pH为多少?
溶液,保持原温度,其溶液的pH为多少?
(3)取上述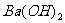 溶液
溶液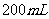 ,加入含
,加入含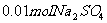 的浓溶液,待反应完全后,上层清液中
的浓溶液,待反应完全后,上层清液中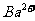 浓度变为多少?[体积变化忽略不计,
浓度变为多少?[体积变化忽略不计,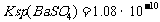 ]
]
30.(7分)由乙酰水扬酸(ASS)制在的阿司匹林是德国一家制药公司于1899年合成出的止痛剂(PainReliefers)。ASS可由下列反应序列合成制得:
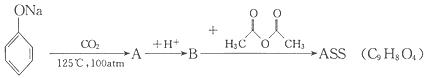
(1)写出A的结构简式 ,B与乙酸酐反应的化学方程式 。
(2)B物质与乙酸酐反应时,还会生成一些副产品,其中有一种是高分子,其结构简式为 。为了除去此物质,可在产物中加入碳酸氢钠溶液,此时发生反应的化学方程式为 ;再经过滤,加入盐酸等步骤可得较纯净的ASS,加盐酸的作用 。
29.(9分)将绿矾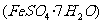 、硫酸铵以相等物质的量混合可制得摩尔盐晶体,
、硫酸铵以相等物质的量混合可制得摩尔盐晶体,
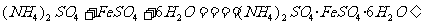 。根据下图回答:
。根据下图回答:
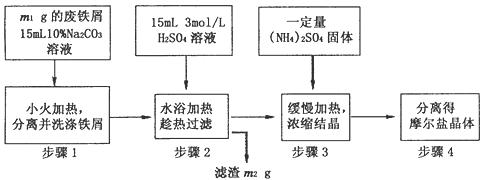
(1)步骤1将铁屑与 溶液分离的方法 。
溶液分离的方法 。
(2)步骤2使铁粉过量,并控制溶液的pH小于1的目的 。
(3)步骤3在蒸发皿中蒸发浓缩至溶液表现出现 为止,静置冷却。
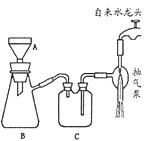
(4)完成步骤4的实验操作装置如下图所示,该操作的名称是 ,简述对摩尔盐晶体洗涤的方法 。
(5)为了确定粗产品中摩尔盐的含量,研究小组用酸化的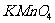 溶液来滴定摩尔盐溶液中的
溶液来滴定摩尔盐溶液中的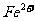 ,现取摩尔盐粗产品
,现取摩尔盐粗产品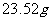 ,配成
,配成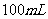 溶液,取出
溶液,取出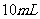 用
用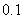
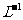
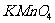 溶液滴定,消耗
溶液滴定,消耗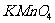 溶液
溶液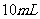 。试计算粗产品中摩尔盐的质量分数 。
。试计算粗产品中摩尔盐的质量分数 。
28.(9分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度,现从市场上买来一瓶某品牌食用白醋,用实验室标准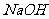 溶液对其进行滴定。下表是4种常见指示剂的变色范围:
溶液对其进行滴定。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用 作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是 。
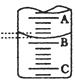
(2)下图表示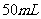 滴定管中液面的位置,若A与C刻度间相差
滴定管中液面的位置,若A与C刻度间相差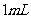 ,A处的刻度为25,滴定管中液面读数应为
,A处的刻度为25,滴定管中液面读数应为 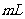 ,此时滴定管中液体的体积 。
,此时滴定管中液体的体积 。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为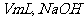 标准液浓度为
标准液浓度为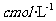 ,三次实验结果记录如下:
,三次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
消耗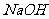 溶液体积/ 溶液体积/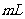 |
26.02 |
25.32 |
25.28 |
从上表可以看出,第一次实验中记录消耗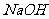 溶液的体积明显多于后两次,其原因可能是 。
溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时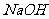 溶液的体积
溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加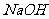 溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(不必化简): 。
27.(7分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
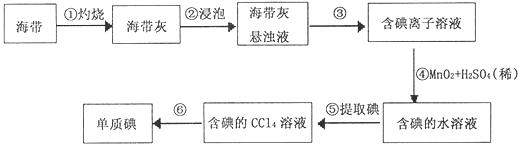
请填写下列空白:
(1)步骤①灼烧海带时,除需要酒精灯外,还需要用到的实验仪器是 (选出所需的仪器,用标号字母填写)。
A.蒸发皿 B.坩埚 C.表面皿 D.三脚架 E.泥三角 F.干燥器
(2)完成步骤③实验操作的需的玻璃仪器有 ;用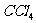 从碘水中萃取得含碘的
从碘水中萃取得含碘的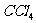 溶液,所用的主要仪器名称是 ,碘的
溶液,所用的主要仪器名称是 ,碘的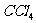 溶液应从该仪器的 (填“下端”或“上口”)注入烧杯中。
溶液应从该仪器的 (填“下端”或“上口”)注入烧杯中。
(3)步骤④反应的离子方程式是 。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
26.(12分)本题共有3个小题,回答有关问题:
(1)检验牙膏中含有甘油的试剂是 ,实验现象 ;有关反应的化学方程式
。
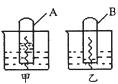
(2)在两烧杯中盛有甲、乙两种不同的稀溶液,用铁丝做电化腐蚀实验。实验进行一段 时间后,A试管中液面高于烧杯中液面,B试管中液面低于烧杯中液面,试比较pH值大小:甲 乙(填“<”、“>”或“=”),并写出A中铁丝发生腐蚀时的电极反应式:
负极 ,正极 。
(3)已知某溶液中只存在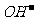 、
、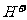 、
、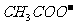 、
、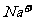 四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
Ⅰ: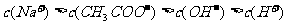
Ⅱ: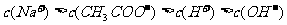
Ⅲ: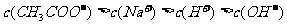
Ⅳ: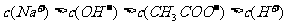
①若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为
(填编号)。
②若上述关系中Ⅲ是正确的,则溶液中溶质为
③若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为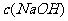
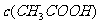 (填“<”“>”或“=”),混合前
(填“<”“>”或“=”),混合前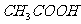 溶液中的
溶液中的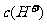
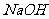 溶液中的
溶液中的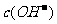 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
25.关节炎病原因是在关节滑液中形成尿酸钠晶体 ( )
①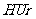 (尿酸)+
(尿酸)+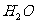

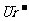 (尿酸根离子)+
(尿酸根离子)+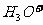
②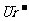 (溶液)+
(溶液)+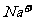 (溶液)
(溶液)
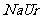 (固)
(固)
第一次关节炎发作大部分在寒冷季节脚趾和手指的关节处。下列叙述不正确的是( )
A.尿酸酸性比盐酸弱 B.尿酸钠的溶解度随温度升高而增大
C.反应①为吸热反应,②为放热反应 D.尿酸钠的熔点很低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com