
33.(6分)2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。运送飞船的火箭燃料除液态H2O2外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为 。
(2)若该物质与液态过氧化氢恰好完全反应,产生两种无毒又不污染环境的物质,写出该反应的化学方程式: 。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式: 。
32.(6分)某核素AZX的氯化物XCl2 1.11g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数: ;
(2)若X的核内中子数为20,求37gXCl2中所含质子的物质的量是: ;
(3)用电子式表示XCl2形成过程: 。
31.(4分)现代物质结构理论原理证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则被称为 。
30.下列关于元素的叙述正确的是 ( )
A.金属元素与非金属元素能形成共价化合物
B.目前使用的元素周期表中,每一周期均由金属元素与非金属元素组成
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
29.下列说法不正确的是 ( )
A.氢键存在于分子之间,不存在于分子之内
B.只含非极性键的分子一定是非极性分子
C.含有极性键的分子不一定是极性分子
D.非极性分子不一定含有非极性键
28.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是 ( )
①H2O ②NH3 ③F- ④CN- ⑤CO
A.①② B.①②③ C.①②④ D.①②③④⑤
27.下图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是 ( )
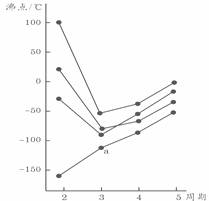
A.SiH4 B.PH3 C.H2S D.HCl
26.下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )
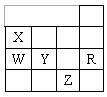
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
25.下列分子中所有原子都满足最外层为8电子结构的是 ( )
A.SiCl4 B.H2O C.BF3 D.PCl5
24.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L 0.5mol/L Na2CO3 溶液中含有的CO32-数目为0.5NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com