
9.下列叙述正确的是 ( )
A.35Cl2与37Cl2互为同位素
B.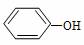 与
与 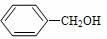 互为同系物
互为同系物
C.淀粉与纤维素互为同分异构体
D.相对分子质量相同,组成元素的百分含量相同的不同有机物一定是同分异构体
8.下列叙述正确的是(NA表示阿伏加德罗常数) ( )
A.H2O2中加入MnO2,当产生0.1 mol O2时转移电子数为0.4 NA
B.某氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目小于3 NA
C.晶体Na2O2和Na2O各1mol,其含有的离子数分别为4 NA和3NA
D.工业上电解法精炼铜,转移1mol电子时阳极上溶解的铜原子数可能少于0.5 NA
7.下列表达正确的是 ( )
A.含有8个中子的碳原子:12C B.氯化铯的晶体结构(晶胞)模型:
C.HF的电子式: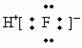 D.Cl-离子的结构示意图:
D.Cl-离子的结构示意图: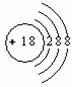
6.下列叙述不正确的是 ( )
A.北京奥运会开幕式上的“脚印”焰火主要是利用了焰色反应的有关知识
B.含有融雪剂(主要成分是CaCl2等)的雪水会对钢筋混凝土建筑造成腐蚀
C.商家不得无偿提供塑料袋的目的是减少“白色污染”
D.用加酶洗衣粉洗涤丝织品时效果会更好
(二)选考题(共45分。请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。如果多做。则每学科按所做的第一题计分)
33.[化学一选修2化学与技术]
(15分)我国规定饮用水质量标准必须符合下表所示要求
|
项目 |
pH |
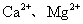 总浓度 总浓度 |
细菌个数 |
|
相关值 |
6.5-8.5 |
<0.0045mol·L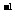 |
<1000个·mL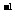 |
下图是源水处理成自来水的工艺流程示意图。

(1)源水中含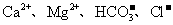 等,离子交换法是用离子交换剂软化水的方法。现在常用离子交换剂的离子交换树脂,是一类不溶于水但能与溶液中相同电性离子进行交换的有机高分子电解质,常用NaR、HR表示。写出用NaR软化水的化学方程式_______;
等,离子交换法是用离子交换剂软化水的方法。现在常用离子交换剂的离子交换树脂,是一类不溶于水但能与溶液中相同电性离子进行交换的有机高分子电解质,常用NaR、HR表示。写出用NaR软化水的化学方程式_______;
(2)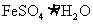 来源充足,是常用的凝聚剂。它在水中最终生成胶状Fe(OH)
来源充足,是常用的凝聚剂。它在水中最终生成胶状Fe(OH)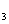 沉淀。凝聚剂除去悬浮固体颗粒的过程_______________(填写编号)
沉淀。凝聚剂除去悬浮固体颗粒的过程_______________(填写编号)
①只是物理过程;②只是化学过程;③是物理和化学过程。
(3)高铁酸钠(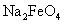 )是一种新型处理剂,它可以代替氯气,在水中反应被还原为Fe
)是一种新型处理剂,它可以代替氯气,在水中反应被还原为Fe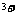 。高铁酸钠能消毒杀菌,这是基于它的________________性质;高铁酸钠用于水处理,除了能消毒杀菌外。它还能沉降水中的悬浮杂质,起到净水作用。请说明其净水原理________________;写出氯气氧化
。高铁酸钠能消毒杀菌,这是基于它的________________性质;高铁酸钠用于水处理,除了能消毒杀菌外。它还能沉降水中的悬浮杂质,起到净水作用。请说明其净水原理________________;写出氯气氧化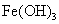 生成
生成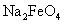 的化学方程式____________。
的化学方程式____________。
34.[化学-选修3物质结构与性质]
(15分)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少。已知砷化镓的晶胞结构如下图所示。请回答下列问题
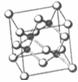
(1)下列说法正确的是________ (填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能As<Ga
C.电负性As<Ga D.砷和镓都属于p区元素
E.半导体GaP、SiC与砷化镓为等电子体
(2)砷化镓可由(CH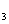 )
)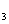 Ga和AsH
Ga和AsH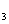 在700℃下反应制得,反应的方程式为______;
在700℃下反应制得,反应的方程式为______;
(3)AsH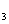 空间形状为______;(CH
空间形状为______;(CH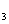 )Ga中镓原子的杂化方式为______;
)Ga中镓原子的杂化方式为______;
(4)Ga的核外电子排布式为__________________________________________;
(5)AsH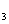 沸点比NH3低,其原因是____________________________________。
沸点比NH3低,其原因是____________________________________。
35.[化学一选修5有机化学基础]
通常羟基与烯键碳原子相连时,发生下列转化如下图。
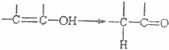
已知有机物A是由C、H、O三种元素组成,其核磁共振氢谱中有三种环境的氢原子且其吸收强度之比为3:2:l,该有机物蒸气密度为相同状况下H 密度的43倍。E能与NaOH溶液反应,F转化为G时,产物只有一种结构且G能使溴水褪色。现有下图所示的转化关系
密度的43倍。E能与NaOH溶液反应,F转化为G时,产物只有一种结构且G能使溴水褪色。现有下图所示的转化关系
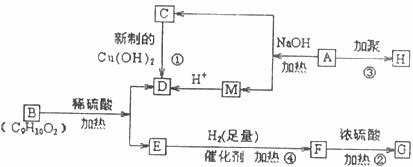
回答下列问题
(1)写出下列反应的基本类型②_______,④_______;
(2)写出A的结构简式___________________________________;
(3)写出反应①的化学方程式__________________________________________;
(4)有机物B有很多同分异构体,其中满足以下条件的B的同分异构体有_______种。
a.分子中有苯环 b.分子中有羧基 c.苯坏上有三个取代基
(一)必考题(8题,共129分)
25.(14分)电解NaCl溶液所得产物均为化工生产中应用广泛的化工原料。请回答下列问题:
(1)写出电解NaCl溶液时两极的电极反应式
阳极_____________________, 阴极_____________________:
(2)常温下,将适量氯气通入NaOH溶液中可制得“漂白水”。若将等物质的量的氯气和NaOH反应则所得溶液容易失效,写出该过程中发生反应的离子方程式_______;
(3)已知氰酸的结构式为H-O-C=N,在反应KOCN+KOH+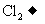 CO
CO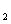 +N
+N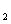 +KCl+
+KCl+
H2O(未配平)中,当有4molCO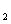 生成时,被氧化的KOCN为_______mol;
生成时,被氧化的KOCN为_______mol;
(4)在25mL0.1
mol/L NaOH溶液中逐滴加入0.2 moL/L CH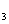 COOH溶液,结合下图找出有关粒子浓度关系对应在图中的点。
COOH溶液,结合下图找出有关粒子浓度关系对应在图中的点。
当在_________点时,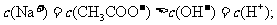
当在_________点时,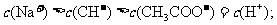
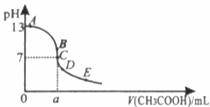
26.(16分)将磷肥生产中形成的副产物石膏(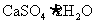 )转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的某工艺流程示意图。
)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的某工艺流程示意图。
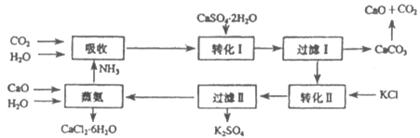
(1)在这个工艺中,有很多粒子都具有相同的电子数。写出该工艺中具有相同电子数的四种粒子的化学式_________________________________________________。
(2)1919年由Langmuir提出了等电子体。原子数相同、电子数相同的粒子,互称为等电子体。A、B、C、D、E、F是原子序数依次增大的6种位于元素周期表前20号的元素。B、C、D、E位于同周期,C是构成空气的主要元素。F与B、D都可形成XY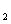 型离子化合物FB
型离子化合物FB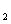 、FD
、FD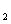 ,且都可与A
,且都可与A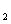 D(无色液体)反应放出气体。B
D(无色液体)反应放出气体。B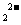 与C
与C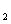 是等电子体,D
是等电子体,D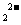 与E
与E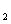 是等电子体。F原子的N层电子数与K层电子数相同。
是等电子体。F原子的N层电子数与K层电子数相同。
①C、D、E对应的简单阴离子的半径由大到小的顺序是(用离子符号表示)_________;
②写出能证明D和E非金属性强弱的一个化学方程式__________________________;
③由上述6种元素中的4种元素组成的离子化合物是(写出两种)________,其中所含的化学键类型有____________;
(3)①过滤Ⅱ所得滤液中大量含有的阳离子有哪些?请分别检验。(可不填满下表)
|
所含离子 |
检验方法 |
|
|
|
|
|
|
|
|
|
②写出此工艺的总反应方程式______________________________________________。
27.(13分)已知 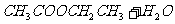


实验目的:验证不同条件下乙酸乙酯的水解程度。
实验步骤:甲、乙、丙三位同学在等体积的乙酸乙酯中分别加入NaOH溶液、蒸馏水、稀硫酸,在相同条件下(同温度、同用量、同时进行)水解。
实验现象与结论:甲想通过观察油层的消失时间来判断不同条件下乙酸乙酯的水解程度;乙想通过测定乙酸的浓度或含量来判断不同条件下乙酸乙酯的水解程度;丙想通过……
请回答下列问题
(1)甲同学为何可以通过观察油层的消失时间来达到实验目的__________________;
(2)乙同学认为可以通过pH试纸测定溶液的pH来判断其不同条件下的水解程度,测定pH的操作是________________。方法是否可行?_________,(填“行”或“不可行”),理由是____________________________________________________________;
(3)你认为丙同学可以通过______________来判断不同条件下乙酸乙酯的水解程度。
(4)要在水解后的溶液中通过蒸馏,得到无水乙醇,除了加入生石灰外,还需要加入_____________,在蒸馏实验中除了酒精灯、蒸馏烧瓶、温度计、接引器外还需要的玻璃仪器有_________________________
13.下列离子方程式中正确的是
A.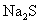 水解
水解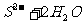


B.酸性高锰酸钾溶液加入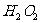 :
:
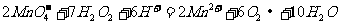
C.水玻璃溶液中通入过量的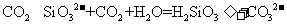
D.惰性电极电解A1C1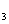 溶液
溶液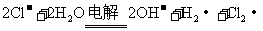
第Ⅱ卷 (非选择题共174分)
12.乙醇燃料电池中采用磺酸类质子溶剂(如下图),在200℃左右时供电,电池总反应为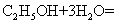
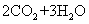 。下列说法中正确的是
。下列说法中正确的是
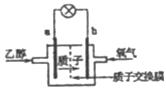
A.电池工作时,质子向电池的负极迁移
B.1mol乙醇被氧化时转移电子数为6mol
C.a极上发生的电极反应是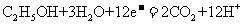
D.用此电池给铅蓄电池充电,消耗4.8g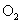 时生成0.6
时生成0.6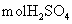
11.一定条件下,向某密闭容器中加入2molX发生如下反应
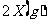

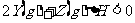 。在
。在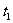 时刻达到平衡,然后在t
时刻达到平衡,然后在t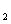 时刻改变某条件,到t
时刻改变某条件,到t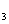 时刻又建立平衡,Z的百分含量变化如下图所示,则t
时刻又建立平衡,Z的百分含量变化如下图所示,则t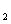 时刻改变的条件是,
时刻改变的条件是,
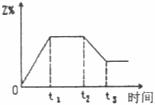
A.升高温度 B.减小压强
C.恒压条件下加入2molX D.加入催化剂
10.用N 表示阿伏加德罗常数,下列有关叙述中错误的是
表示阿伏加德罗常数,下列有关叙述中错误的是
A.6.2g氧化钠和7.8g过氧化钠混合物中所含有的离子总数为O.6N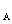
B.1.5mol二氧化氮与足量的水反应,转移的电子数为N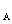
C.25℃时,l L pH=13的NaOH溶液中含氢氧根离子数约为0.1N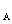
D.含N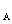 个NO
个NO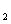 和N
和N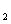 O
O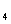 分子的混合气体降温至标准状况,其体积约为22.4L
分子的混合气体降温至标准状况,其体积约为22.4L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com