
1.以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中 加入缓蚀剂。以下可作为缓蚀剂的是
A.KMnO4 B.NANO2 C.FeCl3 D.HNO3
29.(18分)如下图是一套电解装置,两U型管中均盛有50.0 mL电解质溶液,a、b、c、d为 Pt电极。通电一段时间,d电极上析出金属Ag 2.16 g,没有气体产生。同时在b、c两极收集到标准状况下相同体积的气体。请回答:
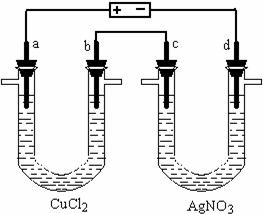
(1)c为______极,写出c电极上的电极反应式:_____________,c极收集到的气体体积在标准状况下为___________L。
(2)b为______极,写出b电极上的电极反应式:开始时是 _____________________、
后来是_________________________________。
(3)原CuCl2溶液中溶质的物质的量浓度为___________mol/L。
28.(7分)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加1-2滴2 mol/L NaOH溶液,观察到有白色沉淀生成,该沉淀的溶解平衡方程式是_______________。再滴加2滴0.1mol/L FeCl3溶液,观察到白色沉淀转化为红褐色沉淀,由以上现象可以推知,相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是_________________,用平衡移动原理解释上述现象____________________________________________。
27.(8分)
(1)写出下列反应的化学方程式和反应类型:
一定条件下丙烯→聚丙烯___________________________,____________。
(2)从乙烷、乙烯、氯气、氯化氢等物质中选取最合适的试剂合成较纯净的1,2-二氯乙烷,写出反应的化学方程式,并说明反应类型。
_______________________________________,____________。
26.(5分)
(1)某烯烃与氢气加成后得到2,2--二甲基丁烷,该烯烃的名称是______
(2)下列为某有机物的结构简式: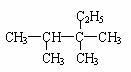 其正确的命名为_____________,
其正确的命名为_____________,
25.下列化合物的分子式可能代表一种以上物质的是 ( )
A.C3H8 B.C4H10 C.CH3Cl D.CH2Br2
24.某烃分子中有1个环状结构和2个双键,它的化学式可能是 ( )
A.C2H4 B.C7H8 C.C5H6 D.C10H8
23.主链上含有5个碳原子,分子中共有7个碳原子的烷烃,其结构式有 ( )
A.4种 B.5种 C.6种 D.7种
22.有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
21.(16分)
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g) ΔH <0
2NH3(g) ΔH <0
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是_____(填序号)。
①20MPa~50MPa ②500℃的高温 ③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
(2)化学平衡常数K表示可逆反应的进行程度,一定条件下合成氨反应的平衡常数表达式为K=__________________________,K值越大,说明___________(填正、逆)向反应进行程度越大;当反应物或生成物浓度变化时,K______________(填增大、减小、不变)。温度升高,合成氨反应的K将_____________(填增大、减小、不变)。
(3)一定条件下NH3的平衡体积分数随n(N2)变化如下图所示 (T-温度)。则T2___T1 (填>、=、<)。
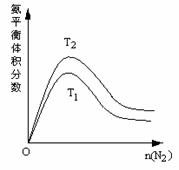
第Ⅱ卷(50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com