
12.现有常温下的四份溶液:①0.01mol/L的CH3COOH溶液;②0.01mol/L的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是 ( )
A.①中水的电离程度最小,③中水的电离程度最大
B.将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性
C.将②、③混合,若pH=7,则消耗溶液的体积:②>③
D.将四份溶液稀释相同倍数后,溶液的pH:③>④,②>①
11.从中药材中提取的金丝桃素对感染H5N1亚型禽流感的家禽活体具有良好的治愈率。已知金丝桃素的结构简式如下图所示。下列有关说法正确的是 ( )
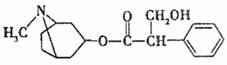
A.金丝桃素的分子式为C17H22O3N
B.金丝桃素不能与浓硫酸和浓硝酸的混合液反应
C.金丝桃素能在NaOH溶液中加热反应得到两种芳香族化合物
D.金丝桃素在一定条件下能发生加成、酯化、消去和氧化反应
10.对下列各种溶液中所含离子的判断合理的是 ( )
A.向无色溶液中加氯水变橙色,溶液中可能含:SO42-、Br-、OH-、Ba2+
B.在pH=7的溶液中可能含有:K+、Na+、Al3+、F‑-
C.加铝粉有氢气放出,则溶液中可能含有:K+、Na+、H+、NO3-
D.在c(H+)=10-14mol/L溶液中可能含有:Na+、AlO2-、CO32-、SO32-
9.下列关于四个图像的说法正确的是 ( )
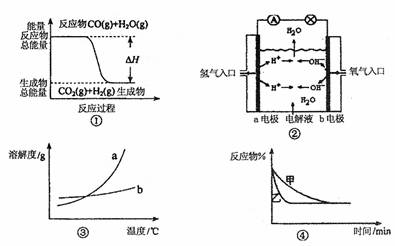
A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H大于0
B.图②为氢氧燃料电池示意图,正、负极通入气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a
D.图④表示压强对可逆反应2A(g)+2B(g)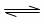 3C(g)+D(s)的影响,乙的压强大于甲
3C(g)+D(s)的影响,乙的压强大于甲
8.用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.6.2克白磷分子中含P-P键为0.6NA
B.10.0 mL18.0mol/L的浓硫酸中氢离子数为0.36 NA
C.6.4 g S6与S8的混合物中所含S原子数一定为0.2 NA
D.80 mL 10mol·L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA
7.运用化学知识可以解决日常生活中遇到的许多问题,下列说法不正确的是 ( )
A.用双氧水的稀溶液清洗伤口可以杀菌消毒
B.家庭可以用铝盐将自来水净化成纯净水饮用以保障身体健康
C.家用的电开水壶的污垢可用食醋除去
D.用酸性的碘化钾淀粉溶液可检验食盐是否为加碘盐
29.(15分)A为含有C、H、O三元素的芳香烃的衍生物,各物质间的相互关系如下图。又已知:ROH+HX RX+H2O;E为高分子化合物,分子式为(C9H8O2)n;H分子式为C18H15O6Na;I中含有一个苯环,还含有一个六元杂环。
RX+H2O;E为高分子化合物,分子式为(C9H8O2)n;H分子式为C18H15O6Na;I中含有一个苯环,还含有一个六元杂环。
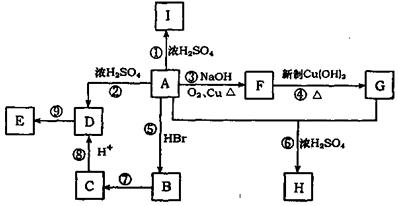
回答下列问题:
(1)写出A的分子式 。I的结构简式 ;
(2)写出有关反应的反应类型:反应②为 ,反应⑤为: ,反应⑨为 ;
(3)反应⑥中浓H2SO4的作用是 ;
(4)写出反应④的化学方程式 ;
写出反应⑦的化学方程式 ;
(5)A的同分异构体有多种,写出符合下列条件的A的两种同分异构体的结构简式。
①A分子中有两个对位取代基;②与FeCl3溶液能发生显色反应;
③能发生银镜反应。
和 。
28.(18分)某学习小组为测定市售过氧化钠纯度,设计了如下方案:
实验原理:2Na2O2+2H2O==4NaOH+O2↑(杂质不参与反应)
仪器装置:如下图。

实验步骤:
①称取过氧化钠样品2.00g;
②把过氧化钠样品放入气密性良好的气体发生装置锥形瓶中(固体体积忽略不计);
③向过氧化钠样品中滴加水,用量气装置测得气体体积为166.00mL(已换算成标准状况);
④锥形瓶中液体体积为54.00mL;
⑤将锥形瓶内液体全部转移入仪器A中,并定容至250.00mL;
请回答下列问题:
(1)仪器A的名称: ;
(2)生成气体的体积为 mL;为保证测定气体体积的准确性,测定时必须做到:
① ;② ;③视线与凹液面最低点持平。
(3)据报导,该反应还会有副反应:Na2O2+2H2O===2NaOH+H2O2,H2O2生成,会使测定结果 (“偏高”、“偏低”、“无影响”)如何避免因生成H2O2造成的误差: ;
(4)为效正实验结果,该小组补做了如下实验:
用滴定管量取20.00mL。A中的液体放入锥形瓶中,用0.010mol/L的H2SO4酸化的高锰酸钾溶液滴定至终点,用去12.00ml。高锰酸钾溶液。其反应为:(未配平)
KMnO4+H2O2+H2SO4→K2SO4+MnSO4+O2+H2O
①滴定时高锰酸钾溶液应装在 中(填仪器名称)。
②此实验未使用指示剂,如何确定终点:
③由上述实验测定数据,计算该过氧化钠样品纯度(写出计算过程)。
27.(14分)下图是多种无机物在一定条件下的转化关系(部分产物及反应条件未列出。)K是形成光化学烟雾及形成酸雨的一种主要气体,N为第三周期元素组成的单质熔点最高的金属,X是一种矿石的主要成份,常用来生产一种常见的化工产品。
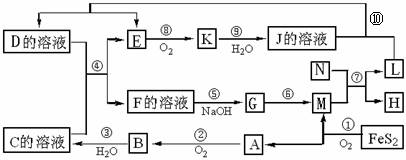
回答:
(1)在周期表,组成单质L的元素位于第 周期第 族。
(2)K的名称为 ,G的化学式 ;
(3)已知X的燃烧热为853KJ/mol,写出反应①的热化学方程式:
(4)写出反应⑤的离子方程式:
写出⑩的离子方程式:
(5)反应⑦中,若转移9 mol电子,生成的L g。
26.(13分)A、B、C、D、E是元素周期表中前20号元素,已知:B元素原子K和L层电子数与其它电子层电子数之和相等;A是形成化合物种类最多的元素;C、D、E同周期,它们最高价氧化物对应水化物两两混合均能反应生成盐和水;E的正负化合价代数和为最大。
(1)B原子结构示意图: ;E离子的电子式 ;
(2)B与E的离子半径:rB rE(填“>”,“<”,“=”);
(3)写出D单质与c的最高价氧化物对应水化物溶液反应的离子方程式:
(4)C与D最高价氧化物的熔沸点 高于 (填“C”或“D”)
(5)B能与A形成B2A3离子化合物,它遇水能发生强烈反应,写出B2A3与水反应的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com