
17.某化学科研小组研究在其他条件不变时,改变某一条件对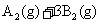

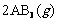 化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是 ( )
化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是 ( )

A.正反应一定是放热反应
B.b点时,平衡体系中A、B原子数之比接近1:3
C.达到平衡时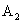 的转化率大小为:
的转化率大小为: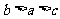
D.正反应一定是吸热反应,且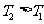
16.如下图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开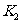 ,闭合
,闭合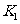 一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开
一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开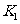 ,闭合
,闭合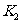 ,观察到电流计A的指针有偏转。下列说法不正确的是 ( )
,观察到电流计A的指针有偏转。下列说法不正确的是 ( )

A.断开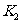 ,闭合
,闭合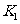 一段时间,溶液的
一段时间,溶液的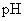 要变大
要变大
B.断开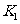 ,闭合
,闭合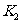 时,b极上的电极反应式为:
时,b极上的电极反应式为: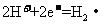
C.断开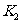 ,闭合
,闭合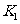 时,a极上的电极反应式为:
时,a极上的电极反应式为: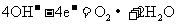
D.断开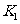 ,闭合
,闭合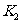 时,
时,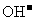 向b极移动
向b极移动
15.常温下,将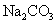 溶液、
溶液、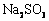 和
和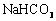 三种溶液混合,所得混合溶液中下列关系一定成立的是 ( )
三种溶液混合,所得混合溶液中下列关系一定成立的是 ( )
A.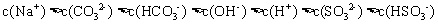
B.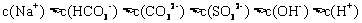
C.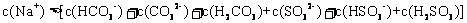
D.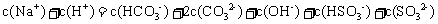
14.用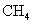 催化还原
催化还原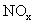 可以消除氮氧化合物的污染。例如:
可以消除氮氧化合物的污染。例如:
①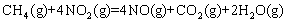 ;
;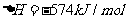
②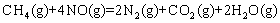 ;
;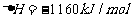
下列说法中不正确的是 ( )
A.等物质的量的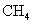 在反应①、②中转移电子数相同
在反应①、②中转移电子数相同
B.若用标准状况下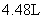
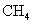 把
把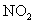 还原为
还原为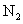 (生成的水为气态),放出热量173.4kJ
(生成的水为气态),放出热量173.4kJ
C.由反应①可推知: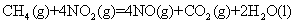 ;
;
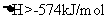
D.若用标准状况下4.48L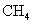 把
把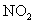 还原为
还原为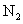 ,整个过程中转移的电子总数为1.6mol
,整个过程中转移的电子总数为1.6mol
13.下列叙述合理的是 ( )
A.直径介于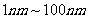 之间的微粒被称为胶体
之间的微粒被称为胶体
B.棉、麻、丝、毛及合成纤维完全燃烧都只生成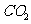 和
和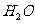
C.在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2的化合物是
D.麻黄碱可用于治疗支气管哮喘
31.[化学--有机化学基础](13分)
有机物A的结构简式如图所示,基团X与一H组成化合物B,基团Y与一H组成化合物C。
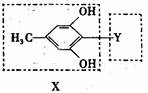
(1)化合物B能发生的化学反应有___________(填编号)
①取代反应 ②加成反应 ③氧化反应 ④加聚反应 ⑤消去反应
(2)写出化合物B与溴水发生反应的化学方程式___________。
(3)C的分子式为C3H6,该物质能使酸性KMnO4溶液褪色。回答下列问题
①C中含有的官能团的名称为___________。
②C的结构可能有___________种。
③1molA与浓溴水反应时最多消耗B为4mol,写出A可能结构中的一种结构简式___________。
30.[化学--物质结构与性质](13分)
氮、磷、砷是同主族元素,该主族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题:
(1)氮原子核外电子运动状态共有_________种,L层的P电子比S电子多________个。
(2)砷原子核外电子排布式为___________。
(3)K3[Fe(CN)6]晶体中存在的化学键有___________(填编号)
①金属键 ②离子键 ③氢键 ④配位键 ⑤极性键 ⑥非极性键
(4)分析表中四种物质的相关数据,请回答:
|
|
CH4 |
SiH4 |
NH3 |
PH5 |
|
沸点/K |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度/K |
873 |
773 |
1073 |
713.2 |
①CH4和SiH4比较,沸点高低的原因是___________。
②NH3和PH5比较,分解温度高低的原因是___________。
③结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时___________先液化
(5)氮化碳结构如下图,其硬度超过金刚石晶体,成为首屈一指的超硬新材料。
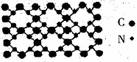
①写出氮化碳的化学式___________。
②指出氮化碳的晶体类型___________。
25.(15分)氧化铜是实验室的常用试剂。某课外活动小组利用氧化铜进行下列实验。
I.实验室有CuO和Cu粉的混合物,某学生想通过实验证明该混合物中含有氧化铜并求得铜的质量分数,设计如下方案:
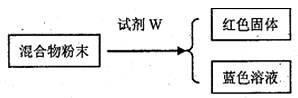
回答下列问题:
(1)试剂W的名称是 ,反应方程式是 。
Ⅱ.为探究氢气的还原性,设计下图所示装置,将干燥的氨气缓缓通过灼热的氧化铜时间后停止加热,黑色的固体粉末变为红色,并收集到氮气。
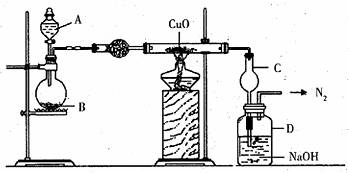
回答下列问题:
(1)写出试剂名称:A B 。
(2)写出氨气与灼热的氧化铜反应的化学方程式 。
(3)能说明氨气具有还原性的实验事实是 。
(4)装置C的作用是 。
(5)装置D的作用是 。
选考部分
第Ⅱ卷选考部分共5小题.共35分。其中,第28、29题为物理题,第30、31题为化学题考生从前两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
24.(15分)某天然碱的化学组成为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数),下面是利用天然碱制备小苏打和烧碱的流程图。
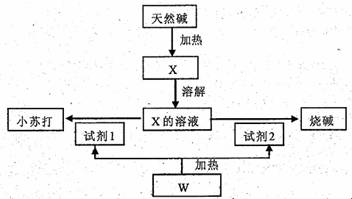
回答下列问题:
(1)向X的溶液中滴入酚酞试液后溶液显 色,原因是(写离子方程式)
。向上述溶液中滴入过量的CaCl2溶液,观察到的现象是 。
(2)上述由X制备小苏打和烧碱的化学方程式: 。
(3)若取3 32g天然碱样品充分加热收集到0.112L(标况)CO2和0.45g H2O,将所得固体于足量稀盐酸中又收集到0.56L(标况)CO2气体,试推算该天然碱的化学组成 。
23.(15分)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别为同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)写出由A、C两元素组成的化合物的分子式 。
(2)E是金属元素,能与D的最高价氧化物的水化物发生反应,其离子方程式为
。
(3)一定条件下,A的气体单质与B的气体单质充分反应生成6.8gBA3气体.可放出18.44kJ热量.则该反应的热化学方程式为 。
(4)A的单质与C的单质在KOH的浓溶液中可以形成电池,写出该电池正极的反应式
|
(5)在10L的密闭容器中,通入2mol的FC2气体和3mol的C气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.2lmol/L,则平衡时FC2的转化率为 ,平衡常数表达式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com