
25.(6分)
(1)某温度下,在一密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如下图所示。分析有关数据,写出X、Y、Z反应的化学方程式 。
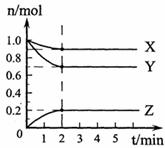
(2)下列情况可以证明(1)中的反应已达到平衡状态的是 (填序号)。
A.物质的浓度:c(X)=c(Y)=c(Z)
B.温度和体积一定时,某一生成物浓度不再变化
C.温度和体积一定时,容器内的压强不再变化
D.温度和体积一定时,混合气体的平均相对分子质量不再变化
(3)某温度下,在另一密闭容器中充入2molX和3molY,然后按(1)中化学方程式进行反应,当达到平衡时,测得Z的物质的量分数为25%,则平衡时X的转化率为 。
24.(10分)某实验小组的同学在做铜与浓硫酸反应的实验时,发现反应结束后,试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有水的烧杯中,发现所得溶液为蓝色,同时仍有黑色固体。
(1)由上述实验可知,原试管底部的白色固体是 。
(2)小李同学认为CuO可能不溶于浓硫酸并猜测黑色固体为CuO,小王根据上述实验立即否定了小李的猜测,小王的依据是 。
(3)为探究黑色固体的组成,小组成员上网检查后获知黑色固体可能是CuS、Cu2S或它们的混合物,同时获知CuS、Cu2S分别都能被浓硝酸氧化为Cu2+和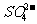 、CuS、Cu2S分别都能在空气中灼烧生成CuO和SO2。
、CuS、Cu2S分别都能在空气中灼烧生成CuO和SO2。
①写出CuS溶于足量浓硝酸的化学方程式: 。
②将烧杯中黑色固体过滤并洗涤干净,加入浓硝酸,待固体溶解后再加入少量BaCl2溶液。该实验过程中,能说明黑色固体中含Cu、S两种元素的实验现象是 。
③若你是该实验小组成员,要进一步探究黑色固体到底是CuS、Cu2S还是它们的混合手,应如何设计实验?请简要叙述: 。
23.(9分)在长期载人的太空飞行宇航器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
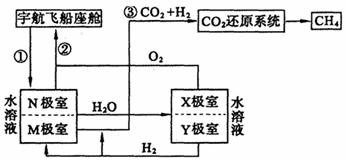
(1)管道①的作用是将飞船座舱中含CO2的空气通入“电化学CO2处理系统”的N极室,通过该电极反应可以使CO2不断被吸收,则N极为 极(填“正”或“负”),其电极反应为: ,其电极产物吸收CO2的离子方程式为 ,在N极吸收CO2后形成的阴离子会通过隔膜进入M极室,与M极上产生的产物反应又生成CO。从电解质溶液中释放出来,并保持系统内pH不变,该电极反应式为 ,CO2逸出的离子方程式为 。
(2)管道②的作用是将处理后的空气混入“电解水系统产生的新鲜氧气”,然后通入飞船座舱内供宇航员呼吸。在电解水系统中,Y为 极(填“阴”或“阳”),X极的电极反应式 。
(3)逸出的CO2没有排出飞船外,而是通过管道③进入“CO2还原系统”,在该系统内,CO2跟H2在一定条件下反应,其产物有甲烷等气体,甲烷可作飞船的燃料。已知甲烷的热值为56kJ/g,则甲烷在足量氧气中燃烧生成CO2和液态水的热化学方程式 。
22.(10分)国家环保总局“环境监测公报”中指出,减少SO2等有害气体的排放和生活废水的处理是我国“十一五”期间环境保护的主要任务。保护我们赖以生存的环境应该成为我们每个人的自觉行动。下面是一些有关大气污染及治理的问题,请回答相关的内容:
(1)分析某地几年内的降雨成分发现,前些年雨水中阴离子主要以SO2-4离子为主,近几年雨水中NO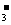 离子的比例有呈明显上升的趋势。通过该地的雨水样本分析,推测该地的大气污染特征是 。
离子的比例有呈明显上升的趋势。通过该地的雨水样本分析,推测该地的大气污染特征是 。
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)某校研究性学习小组收集到一酸雨样本,他们将样本置于敞口容器中并对样本进行一段时间的pH值测定,其测定结果见下表:
|
测试时间/h |
0 |
1 |
2 |
3 |
4 |
6 |
6 |
|
样本的Ph |
4.93 |
4.72 |
4.63 |
4.58 |
4.56 |
4.55 |
4.55 |
请用化学方程式表示该地区酸雨pH随时间增加而减小的原因 。
(3)在工业上采用氨法烟气脱硫技术。其做法是用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合手中通入适量的氨气得到一种复合肥。氨水吸收SO2生成亚硫酸铵的化学方程式 。
(4)为将SO2的污染变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2和得到单质硫。该方法涉及到的化学反应有:
A.XSO2+2XCO====2xCO2+Sx
B.xCO+Sx====xCOS
C.2XCOS+xSO2=2xCO2+3Sx
其中属于氧化还原反应的是 (填字母)。COS分子的电子式为 。
(5)含氮氧化物的气体可以用NH3在一定条件下进行处理,变成两种无毒的物质后排放。下列流程是探究不同催化剂对NH3还原NO反应的催化性能。

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。在催化剂存在下NH3还原NO的化学方程式 。
21.(11分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。B、E同主族,C、F也同主族,B、C同周期。A与B组成的化合物甲为气态,其中A、B原子个数比为4:1。由A与C组成的两种化合物乙与丙均为液态,乙中A、C原子个数比为1:1,丙中A、C原子个数比为2:1。一个D+离子中含有10个电子,D与C可以组成阳离子与阴离个数比为2:1,且相对分子质量为78的化合物丁。回答下列问题:
(1)甲、丁的电子式:甲 ,丁 ;BC2的结构式 ;
F离子的结构示意图 。
(2)①原子半径:D E(填“>”或“<”,下同),
②最高价氧化物对应水化物的酸性:B E,
③稳定单质的熔点:B C。
(3)BC2属于 晶体,EC2属于 晶体(填:原子、分子、离子、金属)。
(4)由A、C、D组成的常见化合物中含有的化学键有 。
(5)乙的水溶液与FC2反应的化学方程式 。
20.已知镁和稀硝酸反应时,当有1 molHNO3参加反应,就有0.8 mol的电子转移,此时硝酸的还原产物可能是 ( )
①NO2 ②NO ③N2 O ④NH4NO3:
A.只有① B.只有② C.只有②或③ D.只有③或④
19.在25°C时,将两个铜电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在阴极上逸出a mol气体,同时析出w克Na2SO4·10H2O晶体,若保持温度不变,此时剩余溶液的质量分数是: ( )
A.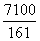 % B.
% B.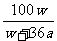 %
%
C.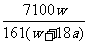 % D.
% D.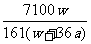 %
%
18.根据下表信息,判断以下叙述正确的是: ( )部分短周期元素的原子半径及主要化合价
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/nm |
0.106 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2E<H2D B.单质与稀盐酸反应的速率为A>C
C.B与E形成的化合物属于分子晶体 D.A2+与D2一的核外电子数相等
17.下列变化中,不需要破坏化学键的是: ( )
A.碘升华 B.氯酸钾分解
C.氯化氢溶于水 D.石墨转变为金刚石
16.将0.6 mol A和0.5 molB充入0.4L密闭容器中发生反应:2A(g)+B(g)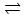 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2
mol。又知5min内用E表示的平均反应速率为0.1
mol·L-1,下列结论正确的是: ( )
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2
mol。又知5min内用E表示的平均反应速率为0.1
mol·L-1,下列结论正确的是: ( )
A.B的转化率为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时反应混合物总物质的量为1 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com