
26.(8分)将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入120mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液中H+浓度为0.1 mol·L-1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4g蓝色固体。(假设反应前后溶液的体积不变)
计算:(1)已锈蚀的铜片中的铜元素的质量分数为 。(保留两位小数)
(2)求铜片中单质铜的物质的量。(写出计算过程)
(3)若生成NO2和NO混合气体共aL(标准状况下)。
①a的取值范围为 。
②原硝酸的浓度为多少?(只需用a的代数式表示,写出过程)
25.(6分)某温度下,将1molN2和 3molH2混合在一密闭容器中发生反应:
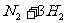

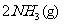 ,达平衡后,测得混合气体的密度是相同条件下H2的5倍,试计算:
,达平衡后,测得混合气体的密度是相同条件下H2的5倍,试计算:
(1)N2的转化率
(2)NH3在平衡混合气体中的体积分数。
(3)平衡前后容器内压强之比。
24.(7分)(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
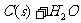

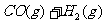 ;ΔH=+131.3
kJ•mol-1(吸热)
;ΔH=+131.3
kJ•mol-1(吸热)
一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母序号)
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
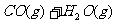

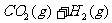 ,得到如下三组数据:
,得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。
23.(8分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应: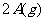 +
+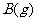

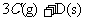 ,反应达到平衡时C的浓度为1.2 mol/L。
,反应达到平衡时C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L
22.(5分)(1)反应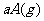

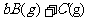 在一容积不变的容器内进行,反应达到平衡后
在一容积不变的容器内进行,反应达到平衡后
①若a=b+c,增大A的浓度,A的转化率 。(填“增大”、“减小”、“不变”)
②若a>b+c,增大A的浓度,A的转化率 。(填“增大”、“减小”、“不变”)
(2)若反应为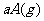

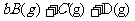 ,容器体积固定不变,且起始时A与B的物质的量之比是a:b,则:
,容器体积固定不变,且起始时A与B的物质的量之比是a:b,则:
①平衡时A与B的转化率之比为 。
②若增大A的浓度,则A的转化率 。(填“增大”、“减小”、“不变”)
③若同时同等倍数地增大A、B的浓度,则(a+b)与(c+d)满足(a+b) (c+d)(填“>”“=”“<”)时,A与B的转化率同时增大。
21.(6分)A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
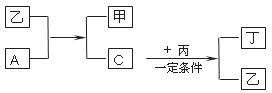
请回答下列问题:
(1)丙的电子式为___________________
(2)A和乙,单质C和丙所发生反应的化学方程式分别为 , 。
(3)丙和丁能否在一定条件下反应?_____(填“能”或“不能”)。若能,请说明理由: 。
20.(11分)某研究性学习小组验证浓硝酸与铜银合金反应时除生成NO2气体外还会生成少量的NO气体。查阅资料得知:常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为此,他们设计了如下图所示的验证实验装置(图中略去了次要装置)
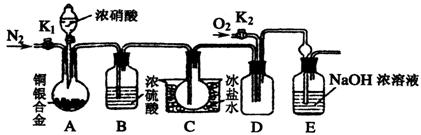
请回答下列问题:
(1)写出A瓶中铜与硝酸可能发生的反应方程式:
、 。
(2)实验开始时要先打开A中的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO气体产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为了便于观察应通入 (填“冷”或“热”)的氧气。
(4)已知合金的质量为ag,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以过到目的,其实验过程为: 。
19.(8分)(1)实验室制备NH3的化学方程式为 ,可采用 法收集。
(2)甲同学用如图B装置做NH3 喷泉实验,关闭K2 ,打开K1 ,用手捂热圆底烧瓶,一段时间后看到烧瓶内有红色喷泉现象。
①请解释形成喷泉的原因: ;
②用方程式表示酚酞变红的原因: ;
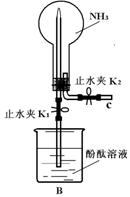
(3)乙同学用B装置做NH3与Cl2反应的实验。
步骤1:关闭K1,打开K2通入Cl2 ,烧瓶中出现白烟,写出反应的化学方程式: 。
步骤2:通入Cl2至恰好完全反应后,关闭K2 ,打开K1 ,烧瓶中的现象是: ;实验完毕后,烧瓶中溶液的体积占烧瓶容积的分数是: 。
18.ag铜、铁与一定量浓硝酸完全反应后,向所得到溶液中加入KSCN溶液无明显变化(即溶液中无Fe3+存在),将所得气体与1.68 L O2(标准状况)混合后通入水中,所有气体能完全被水吸收生成硝酸。若向所得溶液中加入足量NaOH溶液至恰好完全沉淀,则最后生成沉淀的质量为
A.(a+1.25) B. (a+9.6 )g C.(a+5.1) g D.无法确定
第II卷(非选择题,共59分)
17.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:aSnCl2+bCl-+cH3AsO3+dH+=eAs+fSnCl62-+gM。关于该反应的说法中正确的组合是:① 氧化剂是H3AsO3;②M为OH-;③每生成7.5gAs,还原剂失去的电子为0.3 mol;④ SnCl62-是氧化产物。
A.①③④ B.①②④ C.①②③④ D.只有①③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com