
1.下列关于化学学习和研究的说法错误的是( )
A.化学模型有助于解释一些化学现象 B.质量守恒定律是火量试验事实的总结
C.化学家提出的假设都能被实验证明 D.化学基本原理的应用是有一定条件的
27.工业纯碱是用候德榜制碱法制得,工业纯碱样品中常含少量NaC1杂质,兴趣小组为了测定该样品中Na2CO3的纯度,设计以下几种实验方案,其中方案I已实施,并记录了具体数据。
方案一:滴定法:取10.00g样品,配成100mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2GC1+H2O+CO2↑)。完成二次平等实验后,消耗盐酸体积的平均值为30.00mL。
方案二:沉淀法:称取m1g样品溶于水,滴加过量沉淀剂,过滤,将所得沉淀经洗涤、干燥后称得其质量为m2g,用m1、m2计算出Na2CO3的纯度。
方案三:气体体积法:称取mg样品与足量稀H2SO4溶液反应,用排水和碳酸氢钠溶液的方法测得生成的CO2的体积为V3L(已知换成标准状况),用m3、V3计算出Na3CO3的纯度。装置如下图1:
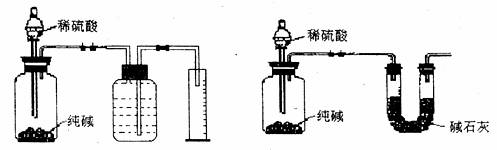
图1 图2
方案IV:气体质量法:称取m1g样品与足量稀H2SO4溶液反应,将生成的气体用碱石灰吸收,称量,测得生成的CO2的质量m3g,用m4、m5计算出N a2CO3的纯度。装置如上图2。
回答下列问答:
(1)方案I中
①滴定时要在锥形瓶下垫一张白纸作用是: ;
②滴定终点时溶液颜色变化是: ;
③若酸式滴定管没有用标准盐酸润洗,会对结果有何影响 (填偏高、偏低或无影响)
④处理数据:计算得纯碱样品的纯度为: ;
(2)方案II中:①沉淀剂选以下哪种最佳? (填编号)
A.AgNO3溶液 B.稀硝酸和AgNO3溶液
C.CaC12溶液 D.BaC12溶液
②怎样检验你所加入的沉淀剂已过量,请简述操作方法:
③为保证所称得的沉淀质量准确,减少实验误差,应将所得沉淀反复干燥、冷却、称重,直至 为止,此时所得固体的质量记为m2g。
(3)方案III和IV相比,你认为误差较大的方案是: (填序号);分析其误差大的理由(至少写三点,多则不限)
①
②
③ ;
26.(11分)铁及铁的化合物应用广泛,如FeC12可用作催化剂、印剧电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuC12溶液中Fe3+和Fe2+的实验步骤:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(3)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,实验铁片明显腐蚀的实验
有关反应的化学方程式 、
铁片腐蚀的实验现象:
25.(10分)现将2.0 molCO2和2.0mol H2注入体积为1L的密闭反应容器中,发生反应
CO2(g) CO(g)+H2O(g)
(1)已知在830℃条件下,反应达到平衡时,CO2的浓度为1.0mol/L,该条件下的平衡常数K1= 。
(2)已知在1200℃时,该反应的平衡常数K2=2.25,求此条件下平衡时
c(H2O)平= ;CO2的转化率a(CO2)= 。
(3)该可逆反应的正反应为 反应(填“吸热”或“放热”)
(4)在(1)基础上把体系的体积压缩在0.5L,该条件下的平衡常数K3。则
K2= K1(填“大于”“小于”或“等于”)。理由是 。
24.(10分)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。(已知:氧化性Fe2+<Ni2+<Cu2+)请回答:
(1)请设计一套电解池完成电解精炼镍的过程,在方框中画出电解池的装置图,标出阳极、阴极的材料电解质溶液的名称,并写出电极反应式:
阳极反应:
阴极反应:
(2)电解后,溶液中存在的金属阳离子有 ;
(3)电解后,电解槽底部和阳极泥的成分是 。
(4)当外电路通过0.1mol电子时,理论上,阴极质量增加 克。
23.(7分)在一定条件下,反应xA+xB zC的可逆反应达到平衡:
(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是 。
(2)已知C是气体且x+y=z,在增大压强时,若平衡发生移动,则一定向 (填“正”或“逆”)反应方向移动;
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为 态;
(4)加热后C的质量分数减少,则正反应是 (填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将 (填“变大”、“变小”或“不变”)。
(5)若A、B、C均为气体,反应的恒温恒压下进。A、B、C的起始浓度分别为:a mol/L,b mol/L, c mol/L,无论反应是从正反应还是从逆反应开始,若要建立相同的平衡状态,a、b、c应满足的条件是 。
22.(8分)
(1)已知,在100℃时纯水中c(OH)=2.0×10-6mol/L,此时水中c(H+)= 。计算在100℃时,0.04mol/L的NaOH溶液的pH= 。
(2)牙齿表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分是:羟基磷酸钙Ca5(PO4)3OH。糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结果化学平衡移动原理,分析其原因:
已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH更小、质地更坚固。用离子方程表示当牙膏中配有氟化物添加剂后能防止龋齿的原因: 。
21.(14分)请按要求填空:
(1)已知磷酸是三元酸,写出磷酸与过量NaOH溶液反应的离子方程式:
次磷酸(H2PO2)与过量NaOH溶液反应的产物是NaH2PO2,则次磷酸可能是
元酸。NaH2PO2溶液呈碱性,用离子方程式解释:
(2)将FeS固体投入到含Hg2+的废水中,可以达到除去Hg2+的目的,请写出转化反应的离子方程式:
(3)碱性锌一锰干电池的结构如下图,其电池反应方程式为:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,请写出正极的电极反应式:

(4)Na2S溶液与A1C13溶液混合,会有白色沉淀和鸡蛋气味的气体生成,请写出反应的离子方程式:
(5)P4(白磷,s)+5O2(g) P4O10(s),△H=2983.2kJ/mol
P(红磷,s)+5/4O2(g) 1/4P4O10(s),△H=-783.5kJ/mol
则白磷转化为红磷的热化学方程式是:
20.0.6mol的Cu(NO3)2和0.4molNaC1溶于水,配成1L溶液,用惰性电极进行电解,当一个电极增重25.6g时,另外一个电极上生成的气体在标准状况下的体积是 ( )
A.5.5L B.4.48L C.6.72L D.11.2L
第Ⅱ卷(非选择题,共60分)
19.下列与金属腐蚀和防护有关的说法正确的是 ( )
A.马品铁(镀锡)一旦被破坏,当在电解质溶液时,铁发生Fe-3e-=Fe3+
B.钢铁在海水中被腐蚀,正极发生的反应为:4OH--4e-=O2↑+2H2O
C.黄铜(镀锌合金)制作的铜锣不易产生铜绿
D.外加电流防治金属腐蚀时,把要保护的金属作为阳极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com