
9.下列现象或反应的原理解释正确的是
|
现象或反应 |
原理解释 |
|
A.铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
|
B.工业上合成氨反应需在较高温条件下进行 |
该反应为吸热反应 |
|
C.NaHCO3溶液可以使酚酞试液变红 |
NaHCO3溶液只水解不电离显碱性 |
|
D.2CO=2C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
8.氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AIN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂。
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
7.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温下,2.24L N2和O2的混合气体所含原子数为0.2NA
B.常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA
C.4 g重水(D2O)中所含质子数为0.2 NA
D.标准状况下,6.72L CO2中所含的共用电子对数为1.2NA
6.A、B、C、D为四种短周期主族元素,且原子序数依次增大。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是
A.原子半径:D>C
B.离子半径:D>B
C.只含B、C元素的化合物仅可由离子键构成
D.最高价氧化物对应水化物的碱性:C>D
5.下列关于反应能量的说法正确的是
A.HI(g) 1/2H2(g)+1/2I2(s);△H=-26.5kJ/mol,由此可知1mol
HI在密闭容器中分解后可以放出26.5kJ的能量
1/2H2(g)+1/2I2(s);△H=-26.5kJ/mol,由此可知1mol
HI在密闭容器中分解后可以放出26.5kJ的能量
B.H+(aq)+OH (aq)=H2O(1);△H=-57.3kJ/mol,含1molNaOH的水溶液与含0.5mol
H2SO4的浓硫酸混合后放热57.3kJ
(aq)=H2O(1);△H=-57.3kJ/mol,含1molNaOH的水溶液与含0.5mol
H2SO4的浓硫酸混合后放热57.3kJ
C.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ/mol,E反应物>E生成物
D.CaCO3(s)=CaO(s)+CO2(g);△H=+178.5kJ/mol,E反应物>E生成物
4.下列装置能达到实验目的的是
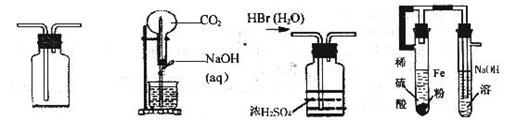
A.作为安全瓶防止倒吸 B.喷泉实验 C.干燥HBr D.制取Fe(OH)2
3.为达到预期的实验目的,下列操作正确的是
A.向无色溶液加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO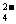
B.用pH试纸测定氯水的pH
C.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
D.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
2.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
A.根据酸电离产生H+的个数将酸分为一元酸、二元酸、多元酸
B.根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
C.根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
D.根据元素原子最外层电子数的多少将元素分为金属和非金属
1.化学与生产、生活、社会密切相关。下列有关说法中不正确的是
A.2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学家钱永健等人。蛋白质都是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔效应。
B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。
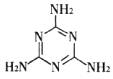
C.三鹿毒奶粉中的三聚氰胺是一种“伪蛋白”,其分子结构如下图所示,其化学式为C3H6N6。
D.2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识。
30.某有机物完全燃烧,生成CO2和水。将12g该有机物完全燃烧的产物通过浓硫酸,浓硫酸增重14.4g;再通过碱石灰,碱石灰增重26.4g。该有机物的分子式为 ,
该有机物可能的结构简式 、 、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com