
1.炒菜时,又加料酒又加醋,可使菜变得香美可口,原因是 ( )
A.有盐类物质生成 B.有酸类物质生成
C.有醇类物质生成 D.有酯类物质生成
24.(8分) 以黄铁矿为原料生产硫酸的工艺流程图如下:
以黄铁矿为原料生产硫酸的工艺流程图如下:
|
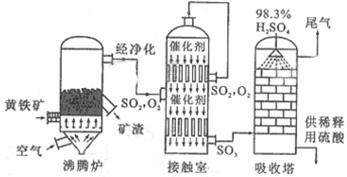
(1)将燃烧黄铁矿的化学方程式补充完整:
4_________+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是_________________________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可制造水泥或制砖,含铁品位高的矿渣可炼铁
(4)每160g SO3气体与液态H2O化合放出260.6kJ的热量,该反应的热化学方程式是
________________________________________________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是_________________________________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是____________%;
若铵盐质量为15.00g,浓硫酸增加的质量为________。(计算结果保留两位小数)
23.(6分)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧: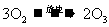
 (1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol (保留一位小数)。
(保留一位小数)。
 (2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为________L。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为________L。
 (3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为________。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为________。
22.(9分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
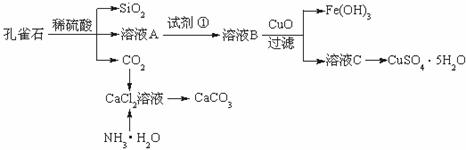



 请回答下列问题:
请回答下列问题:
 (1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
 a.KMnO4 b.(NH4) 2S c.H2O2
d.KSCN
a.KMnO4 b.(NH4) 2S c.H2O2
d.KSCN
 (2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________。
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________。
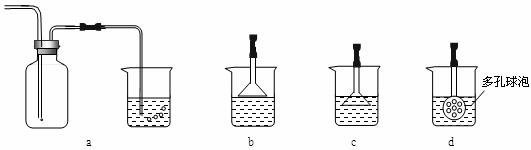
 (3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入)________________(填化学式)。若实验过程中有氨气逸出,应选用下列________装置回收(填代号)。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入)________________(填化学式)。若实验过程中有氨气逸出,应选用下列________装置回收(填代号)。



 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________
____________________________________,直到______________________________。用KMnO4标准溶液滴定时应选用________________滴定管(填“酸式”或“碱式”)。
21.(4分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______________。
(2)已知0.2 mol KBrO3在反应中得到lmol电子生成X,则X的化学式为____________。
(3)根据上述反应可推知______________。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>ASH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:


19.(4分)化合物A(C8H17Br)经NaOH醇溶液处理后生成两种烯烃B1和B2。B2(C8H16)经过:①用臭氧处理;②在Zn存在下水解,只生成一种化合物C。C经催化氢化吸收1 mol氢气生成醇D(C4H10O),用浓硫酸处理D只生成一种无侧链的烯烃E(C4H8)。已知:
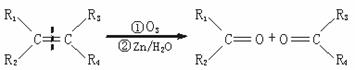
(注:R1、R3可为H或其他烃基)
试根据上述信息写出下列物质的结构简式:
A_______________________________;B2_______________________________;
C_______________________________;E_______________________________。
18.(8分)两个学习小组用下图装置探究乙二酸(HOOC-COOH)受热分解的部分产物。
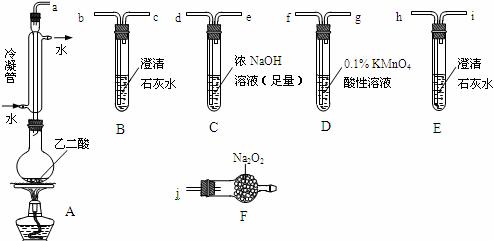
(1)甲组:
|
②乙二酸受热分解的化学方程式为____________________________________________。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为________________________________________________。
②从A~F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。
最简单的装置接口连接顺序是____________________________________;实验后用F中的固体进行验证的方法是____________________________________(可另选试剂)。
17.(8分)现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-,现将它们分别配成0.1 mol·L–1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是______________________________________________
________________________________________________________________。
(2)E溶液是__________,判断依据是___________________________________________
__________________________________________________________________。
(3)写出下列四种化合物的化学式:A___________________、C____________________、
D_____________________、F_____________________。
16.将一定体积稀硝酸溶液平均分为两份,一份与足量的铜粉反应收集到气体体积为V1;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(V1和V2都在同一条件下测定),已知V2=3V1,则稀硝酸和稀硫酸的物质的量浓度之比 ( )
A.1︰1 B.1︰2 C.1︰3 D.无法确定
第Ⅱ卷(非选择题,共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com