
29. (12分)
(12分)
 几种短周期元素的原子半径及其某些化合价见下表:
几种短周期元素的原子半径及其某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
J |
L |
|
常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
|
原子半径(pm) |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
 (1) A、H、L对应离子的半径由大到小的顺序是(用离子符号表示)
;
(1) A、H、L对应离子的半径由大到小的顺序是(用离子符号表示)
;
 (2) A与L所形成的是
化合物(填:“离子”或“共价”);
(2) A与L所形成的是
化合物(填:“离子”或“共价”);
 (3) DB2的结构式为
;
(3) DB2的结构式为
;
 (4) D的最高正价氧化物与L的最高正价氧化物对应水化物X的溶液(足量)发生反应的离子方程式
;
(4) D的最高正价氧化物与L的最高正价氧化物对应水化物X的溶液(足量)发生反应的离子方程式
;
 (5) E的最高正价氧化物对应水化物y的浓溶液与Cu发生反应的化学方程式为
(5) E的最高正价氧化物对应水化物y的浓溶液与Cu发生反应的化学方程式为
 。
。
28. (13分)
(13分)








 某校研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是
某校研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是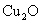 提出质疑。
提出质疑。
 (1)甲小组认为红色沉淀不一定是
(1)甲小组认为红色沉淀不一定是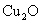 ,为此展开了确定红色沉淀成分的研究:
,为此展开了确定红色沉淀成分的研究:
 步骤一提出假设:
;
步骤一提出假设:
;
 步骤二查阅资料,得出:①+l价的铜在酸性条件下易发生自身氧化还原反应生成
步骤二查阅资料,得出:①+l价的铜在酸性条件下易发生自身氧化还原反应生成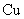 和Cu2+;②在空气中灼烧氧化亚铜生成氧化铜;
和Cu2+;②在空气中灼烧氧化亚铜生成氧化铜;
 步骤三设计方案、实验:
步骤三设计方案、实验:
 A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化;
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化;
 B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
 C.取该红色沉淀a g,在空气中充分灼烧至完全变黑,放在干燥器里冷却,再称重,反复多次至固体恒重,称得质量为b g,比较a、b的关系;
C.取该红色沉淀a g,在空气中充分灼烧至完全变黑,放在干燥器里冷却,再称重,反复多次至固体恒重,称得质量为b g,比较a、b的关系;
 D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色沉淀析出;
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色沉淀析出; 你认为合理的方案是(填序号) 。
你认为合理的方案是(填序号) 。
 (2) 乙小组针对甲小组的假设,另设计如下图装置进行验证:
(2) 乙小组针对甲小组的假设,另设计如下图装置进行验证:

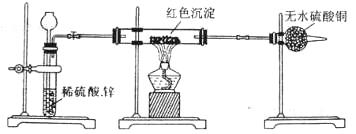
 若按乙组装置定性检验上述红色沉淀成分,可根据
若按乙组装置定性检验上述红色沉淀成分,可根据
 现象的发生与否即可判断.
现象的发生与否即可判断. 若按乙组装置定量测定上述红色沉淀的成分,你认为理论上需要测定下列物理量是
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上需要测定下列物理量是
 (填序号);
(填序号);
 ①通入氢气的体积;
②反应前红色沉淀和硬质玻管的总质量;
①通入氢气的体积;
②反应前红色沉淀和硬质玻管的总质量;
 ③完全反应后红色固体和硬质玻璃管的总质量; ④实验前干燥管质量;
③完全反应后红色固体和硬质玻璃管的总质量; ④实验前干燥管质量;
 ⑤硬质玻璃管质量;
⑥锌粒质量;
⑤硬质玻璃管质量;
⑥锌粒质量;
 ⑦稀硫酸中含溶质的量;
⑧实验后干燥管质量;
⑦稀硫酸中含溶质的量;
⑧实验后干燥管质量;
 该实验装置中在实际可行性方面存在的缺陷有
;
该实验装置中在实际可行性方面存在的缺陷有
;
 (请写出两点)。
(请写出两点)。
27. 取两份铝粉,第一份加足量NaOH溶液,第二份加足量的盐酸,若放出等量的气体,则两份铝粉的质量比为
取两份铝粉,第一份加足量NaOH溶液,第二份加足量的盐酸,若放出等量的气体,则两份铝粉的质量比为
 A.1:2 B.1:3 C.1:1 D.2:3
A.1:2 B.1:3 C.1:1 D.2:3
26. 下列各组离子一定能大量共存且符合要求的溶液是
下列各组离子一定能大量共存且符合要求的溶液是
 A.无色溶液中:K+、H+、
A.无色溶液中:K+、H+、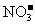 、Cu2+
、Cu2+
 B.能与铝片反应产生氢气的溶液中:Al3+、Cl一、Fe2+、
B.能与铝片反应产生氢气的溶液中:Al3+、Cl一、Fe2+、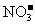
 C.常温下,pH=12的溶液中:
C.常温下,pH=12的溶液中: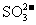 、
、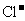 、K+、
、K+、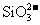
 D.含有较多Fe3+的溶液中:Na+、
D.含有较多Fe3+的溶液中:Na+、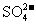 、SCN一、I一
、SCN一、I一
25. 现有一瓶乙二醇和丙三醇的混合液,已知它们的性质如下表:
现有一瓶乙二醇和丙三醇的混合液,已知它们的性质如下表:
|
物质 |
分子式 |
熔点(℃) |
沸点(℃) |
密度(g/cm3) |
溶解性 |
|
乙二醇 |
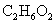 |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
|
丙三醇 |
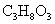 |
17.9 |
290 |
1.26 |
能与水和酒精以任意比混溶 |
据此,将乙二醇和丙三醇互相分离的最佳方法是
 A.萃取法 B.分液法 C.分馏法 D.蒸发法
A.萃取法 B.分液法 C.分馏法 D.蒸发法
24. 2008北京奥运会主体育场--“鸟巢”使用了高强度的钒氮合金高新钢和884块ETFE膜,并采用了新一代的氮化镓高亮度LED材料。下列有关说法正确的是
2008北京奥运会主体育场--“鸟巢”使用了高强度的钒氮合金高新钢和884块ETFE膜,并采用了新一代的氮化镓高亮度LED材料。下列有关说法正确的是
 A.合金的熔点通常比各组分金属的熔点高
A.合金的熔点通常比各组分金属的熔点高
 B.已知镓(Ga)处于IIIA族,可推知氮化镓化学式为Ga3N2
B.已知镓(Ga)处于IIIA族,可推知氮化镓化学式为Ga3N2
 C.ETFE膜
C.ETFE膜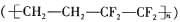 是一种无机材料
是一种无机材料
 D.用金属铝与V2O5在高温条件下可以冶炼钒,该反应铝被氧化
D.用金属铝与V2O5在高温条件下可以冶炼钒,该反应铝被氧化
23. 2008年的中国举世关注,有关下列事件说法不正确的是
2008年的中国举世关注,有关下列事件说法不正确的是







 A.“5.12”汶川大地震后可先将漂白粉和“洁厕剂(内含盐酸)”混合后再运送到灾区作为消毒剂
A.“5.12”汶川大地震后可先将漂白粉和“洁厕剂(内含盐酸)”混合后再运送到灾区作为消毒剂
 B.自2008年6月1日起,实行塑料购物袋有偿使用可达到节能减排的目的
B.自2008年6月1日起,实行塑料购物袋有偿使用可达到节能减排的目的
 C.北京奥运奖牌--“金镶玉”奖牌中玉的化学成分多为含水钙镁硅酸盐
C.北京奥运奖牌--“金镶玉”奖牌中玉的化学成分多为含水钙镁硅酸盐
 [Ca2Mg5Si8O22(OH)2],它可表示为2CaO·5MgO·8SiO2·H2O
[Ca2Mg5Si8O22(OH)2],它可表示为2CaO·5MgO·8SiO2·H2O
 D.为实现“绿色奥运”承诺,北京为汽车加装了“三效催化净化器”,可将尾气中的CO、NO转化为无毒混合气体CO2、N2
D.为实现“绿色奥运”承诺,北京为汽车加装了“三效催化净化器”,可将尾气中的CO、NO转化为无毒混合气体CO2、N2
22. (14分)
(14分)
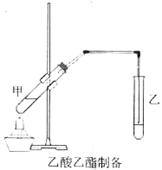
 如图在试管甲中先加入2 mL 95%的乙醇,并在摇动下缓缓
如图在试管甲中先加入2 mL 95%的乙醇,并在摇动下缓缓 加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5 mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5 min后,改用大火加热,当观察到乙试管中有明显现象时停止实验。试回答:(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5 mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5 min后,改用大火加热,当观察到乙试管中有明显现象时停止实验。试回答:(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
 (1) 试管乙中观察到的现象是
:
(1) 试管乙中观察到的现象是
:
 (2) 液体混合加热时液体容积不能超过其容积的
,放入碎瓷片可防止 ,本实验反应开始时用小火加热的原因是 ;
(2) 液体混合加热时液体容积不能超过其容积的
,放入碎瓷片可防止 ,本实验反应开始时用小火加热的原因是 ;
 (3) 试管甲中加入浓硫酸的目的是
:
(3) 试管甲中加入浓硫酸的目的是
:
 (4) 实验结束时可用
(填仪器名称)将乙酸乙酯与饱和碳酸钠溶液分离;
(4) 实验结束时可用
(填仪器名称)将乙酸乙酯与饱和碳酸钠溶液分离;
 (5) 写出乙酸和Na2CO3溶液反应的化学方程式
.
(5) 写出乙酸和Na2CO3溶液反应的化学方程式
.
 B卷(满分50分)
B卷(满分50分)
21. (6分)
(6分)
 欲除去下表中有关物质中的杂质,用序号填写所用试剂及主要操作步骤:
欲除去下表中有关物质中的杂质,用序号填写所用试剂及主要操作步骤:
|
|
选用试剂 |
主要操作 |
 中混有少量 中混有少量 |
|
|
|
甲烷气体中混有乙烯气体 |
|
|
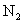 中混有少量 中混有少量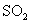 气体 气体 |
|
|
供选试剂:(a)溴水;(b)盐酸;(C)BaCl2溶液;(d)NaOH溶液;(e)饱和Na2CO3溶液;
 供选操作:①过滤;②蒸馏;③分液;④通过干燥管;⑤通过洗气瓶:⑥加强热。
供选操作:①过滤;②蒸馏;③分液;④通过干燥管;⑤通过洗气瓶:⑥加强热。
20. (12分)
(12分)
 现有部分短周期元素的性质或原子结构如下表:
现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
甲 |
有三个电子层,且K、M层电子数之和等于L层电子数 |
|
乙 |
最外层电子数是次外层电子数的2倍 |
|
丙 |
常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
|
丁 |
与乙元素同族 |
(1) 写出甲元素在周期表中的位置 ;
 (2) 写出丙元素形成气态氢化物的结构式 :
(2) 写出丙元素形成气态氢化物的结构式 :
 (3) 元素丁与元素乙相比,非金属性较强的是
(用元素符号表示),下列表述中能证明这一事实的是
(填选项序号);
(3) 元素丁与元素乙相比,非金属性较强的是
(用元素符号表示),下列表述中能证明这一事实的是
(填选项序号);
 a.最高正价氧化物对应水化物酸性丁强于乙
a.最高正价氧化物对应水化物酸性丁强于乙
 b.乙的氢化物比丁的氢化物稳定
b.乙的氢化物比丁的氢化物稳定
 c.一定条件下丁和乙的单质都能与氧气反应
c.一定条件下丁和乙的单质都能与氧气反应
 (4) 探寻物质的性质差异性是学习的重要方法之一,甲、乙、丙三种元素的最高价氧化物的水化物中化学性质明显不同于其他二种的是
(写化学式),理由是
(4) 探寻物质的性质差异性是学习的重要方法之一,甲、乙、丙三种元素的最高价氧化物的水化物中化学性质明显不同于其他二种的是
(写化学式),理由是 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com