
17.(8分)
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A位于元素周期表的s区,其基态原子中没有成对电子;B的气态氢化物能与其最高价氧化物的水化物反应生成一种盐;C元素原子得两个电子后2p轨道全满,C2-与D2+具有相同的核外电子排布;E的最高化合价和最低化合价的代数和为4,与C在周期表中处于相邻位置。回答下列问题:
(1)写出下列元素的符号:A , D ,E 写出基态B原子的轨道表示式
(2)在这五种元素中,电负性最大的元素是 (填元素符号)。B的第一电离能比C大的原因是: 。
(3)化合物DC与化合物DE相比,熔点较高的物质是 (填化学式),原因是:
16.(12分)
下图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标明第VIIA族和碳、钾两种元素的位置,各字母对应相应元素的位置。回答下列问题:
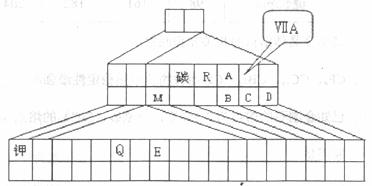
(1)请在上图中将d区元素所在的部分涂上阴影。
(2)E元素在元素周期表中的位置为 。
(3)在所标出的元素中,单质化学性质最不活泼的是: (填具体元素符号或化学式,下同);在最高价氧化物的水化物中,酸性最强的化合物是 。
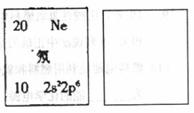
(4)下图是周期表中氖元素的一种核素的表示方法。已知Q元素的一种核素中子数为28,请按该样式在图的右边方框中表示出Q元素的这种核素。
(5)用一个化学反应比较A、B两元素的非金属性强弱,请写出化学方程式:
15.(8分)
室温下,将完全相同的锌片分别投入100mL、0.1 mol· L-1的稀硫酸和100 mL、0.2mol·L-1的稀盐酸中,仔细观察后发现,两者反应速率有明显差异:投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸中的快。经分析讨论,大家认为产生这一现象的原因有两种可能:l、氯离子对反应起了正催化作用,即氯离子加快了反应的进行:2、硫酸根离子对反应起了负催化作用,即硫酸根离子阻碍了反应的进行。赞成前一种观点的几位同学设计了实验方案,他们的实验操作、实验现象和相关结论如下:
室温下,分别取100 mL、0.1 mol·L-1的稀硫酸溶液于两个相同的烧杯中,一个烧杯中加一定量的下表中固体,另一个烧杯作对比实验,再分别同时加入完全相同的锌片:
|
实验同学 |
实验操作 |
实验现象 |
实验结论 |
|
甲 |
加入适量氯化钠固体 |
反应速率加快 |
氯离子对反应起了正催化作用 |
|
乙 |
加入少量氯化铜固体 |
||
|
丙 |
加入适量氯化钡固体 |
||
|
丁 |
加入适量氯化锌固体 |
据此,试回答下列问题:
(1)对上述实验及现象,下列说法中正确的是: (填编号)。
A.实验中稀盐酸的浓度是稀硫酸的2倍,因此稀盐酸反应速率快是必然的,不需要进一步研究;
B.稀硫酸具有强氧化性,使锌表面钝化,故硫酸反应速率慢;
C.根据锌与酸发生置换反应的实质,要比较锌与稀盐酸和锌与稀硫酸在相同条件下的反应速率,必须使稀盐酸的浓度是稀硫酸的2倍;
D.在比较锌与稀盐酸和稀硫酸的反应速率时,应用了控制变量法,同学们根据实验现象作出的可能原因分析是合理的。
(2)甲、乙、丙、丁四位同学根据实验现象得出的结论最合理的是 (填编号)。
A. 甲 B.乙 C.丙 D.丁
(3)请你在不能得出“氯离子对反应起了正催化作用”结论的同学的实验方案中选择一个方案进行评价,简要说出不能得出该结论的理由。
14.下列说法或表示方法正确的是
A.燃料的燃烧反应都是放热反应
B.由C(石墨)=C(金刚石)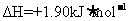 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定
C.等物质的量的硫蒸气和硫固体分别完全燃烧生成SO2气体,前者放出的热量多
D.已知: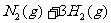

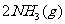
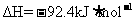 ,则相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放出92.4 kJ的热量
,则相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放出92.4 kJ的热量
第II卷(非选择题共72分)
13.下图是Zn和Cu组成的原电池,某兴趣小组做完实验后,在读书卡片上记录如下:卡片上描述合理的是
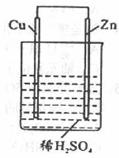

A.①②③ B.④⑤⑥ C.②③⑥ D.③④⑤
12.下列说法中正确的是
A.p电子绕核旋转,其轨道形状为球形
B.原子核外电子的自旋有两种不同的状态
C.原子核外第3电子层,有s、p、d、f四种类型的原子轨道
D.电子云图中小黑点的疏密程度表示了原子核外电子密度的大小
11.设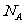 为阿伏加德罗常数的值。下列叙述中正确的是
为阿伏加德罗常数的值。下列叙述中正确的是
A.常温常压下,40g NaOH中含有的离子总数为2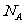
B.标准状况下,11.2 L CCl4含有的分子数为0.5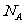
C.常温常压下,31 g白磷和红磷的混合物含有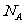 个磷原子
个磷原子
D.4 g重水(D2O)中所含质子数为0.2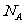
10.下列有关物质性质的比较中,正确的是
①热稳定性:CH4>NH3>H2O ②还原性: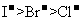
③碱性:NaOH>Mg(OH)2>Al(OH)3 ④原子半径:O>Na>Mg
A.①③ B.②④ C.②③ D.①④
9.分类是化学研究中常用的方法。下列分类方法中,不正确的是
A.依据构成微粒及微粒间的作用不同,将晶体分为离子晶体、原子晶体等
B.依据使用后能否复原,将化学电源分为一次电池和二次电池
C.依据原子的堆积方式,将金属晶体的晶胞类型分为六方、面心立方和体心立方等
D.依据原子轨道的重叠方式,将共价键分为极性键和非极性键
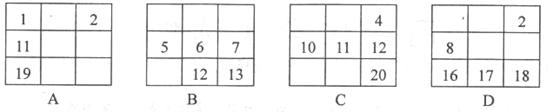
8.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在周期表中位置相符的一组是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com