
2.下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定化合物的是
A.3和17 B.1和8 C.1和6 D.7和12
1.化学与生活、社会密切相关。下列说法不正确的是
A.为了防止污染环境,废弃的塑料应焚烧处理
B.误食重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶
C.为防止电池中的重金属元素污染土壤和水体,应积极开发废电池的综合利用技术
D.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
22.(8分)近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。
(Ⅲ)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
①写出步骤(Ⅰ)反应的化学方程式:___________________________;
②写出步骤(Ⅲ)反应的离子方程式:___________________________。
(2)还有学者提出利用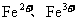 等离子的催化作用,常温下将SO2氧化成
等离子的催化作用,常温下将SO2氧化成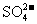 而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成
而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成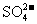 的转化率。
的转化率。
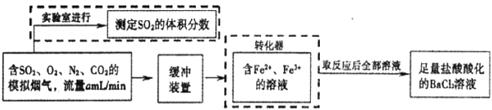
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是_________。
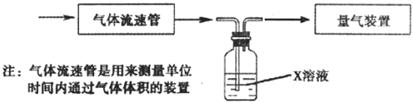
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
②若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成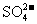 的转化率,已知气体流速和SO2的体积分数,还需测定的数据是__________________。
的转化率,已知气体流速和SO2的体积分数,还需测定的数据是__________________。
21.(7分)近年来,镁在汽车、航天、航空,机械制造、军事等产业中应用迅猛发展。
(1)某研究性学习小组探究以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池(如下图所示)时发现,刚开始,电表指针向右偏转,镁条做负极;但随后很快指针向左偏转,镁条表面有极少量的气泡产生。
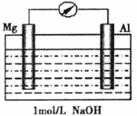
①开始阶段,负极发生的反应是___________________________。
②随后阶段镁条表面只有极少量的气泡产生,其原因是: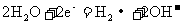 ,试写出镁电极发生的主要反应的电极反应式___________________________。
,试写出镁电极发生的主要反应的电极反应式___________________________。
(2)经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如下图所示。某同学拟用1.2g镁与100m1硝酸反应制取二氧化氮,硝酸的物质的量浓度至少为________________。
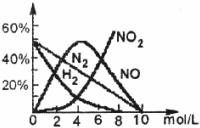
20.(9分)在一固定容积的密闭容器中,进行如下化学反应:
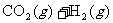


其化学平衡常数K和温度 的关系如下:
的关系如下:
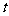 ℃ ℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)上述反应中Q_________0(选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是_________。
A.容器中压强不变 B.反应热△H不变
C.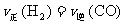 D.CO2的质量分数不变
D.CO2的质量分数不变
(3)温度为850℃时,可逆反应

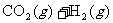 在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
850℃时物质浓度(mol/L)的变化
|
时间(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
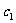 |
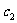 |
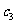 |
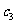 |
|
4 |
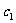 |
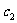 |
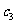 |
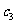 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:3min时H2O(g)的转化率=_________。
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是_________(单选),表中5min-6min之间数值发生变化,可能的原因是_________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
19.(8分)A、B、C、D、E五种短周期元素,其原子序数依次增大。其中,C与E可形成原子个数比分别为1︰1和1︰2的两种离子化合物;A与E同主族;B与E的原子序数之和等于C与D的原子序数之和。请回答下列问题:
(1)C与E形成的一种化合物可与BC2发生氧化还原反应,该化合物中含有的化学键类型是__________________;
(2)由D和E两种元素组成的化合物溶于水所得溶液中各种离子的浓度由大到小的顺序是__________________;
(3)等物质的量的D单质与E的氢氧化物在一定条件下恰好完全反应,生成一种盐、水和一种气体,该反应的化学方程式为___________________________;
(4)以金属Pt为电极,以E的氢氧化物的溶液作电解质溶液,将A、C的单质分别通入到两个电极上,可以构成原电池。该电池中负极上的电极反应式为___________ ________________________。
18.(8分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
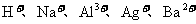 |
|
阴离子 |
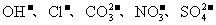 |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,各种离子之间的电荷守恒关系为___________________________。
(2)已知: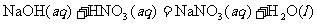 ,
,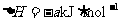 。请写出B与C的稀溶液反应的热化学方程式___________________________。
。请写出B与C的稀溶液反应的热化学方程式___________________________。
(3)在100mL 0.1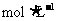 E溶液中,逐滴加入35mL 2
E溶液中,逐滴加入35mL 2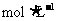 NaOH溶液,最终得到沉淀的物质的量为_________。
NaOH溶液,最终得到沉淀的物质的量为_________。
17.(12分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如下图所示(其中某些反应条件和部分反应产物已略去)。
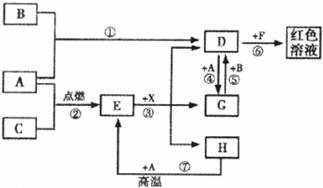
(1)X物质的化学式:_________。
(2)在反应①-⑦中,不属于氧化还原反应的是_________(填编号)。
(3)反应④的离子方程式为:___________________________。
(4)往G溶液中加入NaOH溶液观察到的现象是___________________________。
(5)反应⑦的化学方程式为___________________________;该反应中每消耗0.3mol的A,可转移电子_________mol。
16.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示(未配平):
①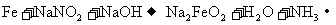
②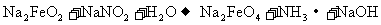
③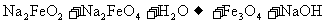
下列说法正确的是
A.反应①不是氧化还原反应
B.该生产过程不产生任何污染
C.整个反应过程中,每有5.6gFe参加反应转移0.8mol电子
D.反应②中的氧化剂是NaNO2
第Ⅱ卷(非选择题 共52分)
15.恒温恒压下1mol A和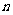 molB在一个容积可变的密闭容器中发生如下反应:
molB在一个容积可变的密闭容器中发生如下反应:

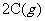 ,一段时间后达到平衡,生成
,一段时间后达到平衡,生成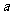 mo1 C。则下列说法中正确的是
mo1 C。则下列说法中正确的是
A.物质A、B的转化率之比一定是1︰2
B.若起始时放入3molA和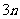 mol B,则达平衡时生成
mol B,则达平衡时生成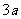 mol C
mol C
C.起始时刻和达平衡后容器中的压强比为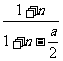
D.当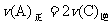 时,可断定反应达平衡状态
时,可断定反应达平衡状态
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com