
20.下列说法中正确的是( )
A.干冰气化和I2升华克服的作用力相同
B.金属导电的实质是金属阳离子在外电场作用下的定向移动
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
19.下面的排序不正确的是 ( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.熔点由高到低:Na>Mg>Al
C.硬度由大到小:金刚石>碳化硅>晶体硅
D.晶格能由大到小: NaF> NaCl> NaBr>NaI
18.下列有关叙述正确的是( )
A.氢键是一种特殊化学键,它广泛地存在于自然界中
B.在--COOH分子中含有1个手性C原子
C.碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子。
D.含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
17.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后配离子的种类不变
B.沉淀溶解后,将生成深蓝色的配离子[Cu(H2O)4] 2+
C.在[Cu(NH3)4] 2+离子中,Cu2+提供空轨道,NH3给出孤对电子
D.配位体形成配位键的能力:H2O> NH3
16.下列说法中正确的是( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.同周期元素的原子半径从左到右逐渐增大,故电负性必依次减小
C.最外层有2个电子的原子都是金属原子,最外层有5个电子的原子都是非金属原子
D.同周期元素的非金属性逐渐增大,故碳元素的第一电离能大于氮元素的第一电离能
15.下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
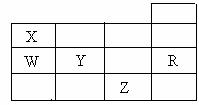
A.常压下五种元素的单质中,Z单质的沸点最高
B.R最外层电子排布为2s22p6,第一电离能较大
C.由于X对应的气态氢化物存在分子间的氢键,故沸点高于W对应的气态氢化物的沸点
D.最高价氧化物对应的水化物的酸性:Y<W
14.下列物质的立体结构与NH3相同的是( )
A.H2O B.H3O+ C.CH4 D.CO2
13.下列化学式中,能真实表示物质的分子组成的是( )
A.NaCl B.CO2 C.SiO2 D.CsCl
12.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极 性键形成的是( )
A.Cl2+H2O=HCl+HClO B.2Na2O2+2CO2=2Na2CO3+O2
C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ D.NaOH+HNO3=NaNO3+H2O
11.下列分子中,所有原子都满足最外层为8电子结构的是( )
A.XeF2 B.BCl3 C.HClO D.CF2Cl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com